Bagaimana Cara Mengisolasi Mesenchymal Stem Cell (MSC) dengan Flow Cytometry
Pendahuluan
Mesenchymal Stem Cell (MSC) telah dipelajari secara luas selama ~30 tahun terakhir karena biologi selnya yang menarik, memiliki potensi klinis yang luas, dan sebagai blok penyusun utama dalam bidang rekayasa jaringan yang berkembang pesat. MSC dapat tumbuh dengan mudah dalam cawan kultur, memiliki potensi diferensiasi intrinsik yang sebelumnya tidak ditemukan pada sel lain, dan menghasilkan banyak faktor pertumbuhan dan sitokin yang bermanfaat.
Isolasi MSC dari berbagai jaringan dan penanaman sel tersebut kembali di tempat lain menimbulkan pertanyaan tentang MSC alami in vivo dan kemampuannya untuk memperbaiki jaringan endogen secara normal, suatu proses yang jelas berkurang seiring bertambahnya usia. Penggantian sel mesenkim dalam jumlah besar yang diperlukan untuk mengobati cedera jaringan. Friedenstein adalah orang pertama yang membudidayakan sel pembentuk tulang dari marmut dan Owen kembali menghidupkan penelitian ini dengan memperluas penelitian tersebut ke tikus. Isolasi dan perluasan kultur MSC sumsum tulang manusia dilaporkan pada tahun 1992 dan infusnya ke pasien dimulai sejak tahun 1993 sebagaimana dilaporkan pada tahun 1995.
Jaringan sumber dewasa yang paling umum dan paling lama digunakan untuk MSC manusia adalah sumsum tulang dan fraksi vaskular stroma jaringan adiposa dan sumber-sumber ini membentuk dasar bagi sebagian besar data dalam bidang ini.
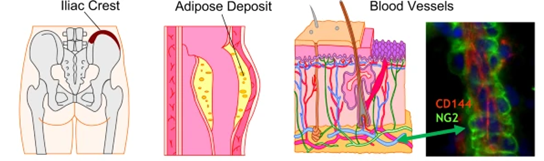
Gambar 1. MSC dapat dengan mudah diisolasi dari sumsum tulang dan jaringan adiposa, tetapi semua jaringan mengandung sel-sel seperti MSC sebagai bagian dari pembuluh darah mikro (Pittenger dkk., 2019)
MSC adalah jaringan manusia yang dapat dipanen dan dianggap dapat diperbarui (sumsum tulang) atau tidak diinginkan (adiposa). Ada juga dua jaringan “dewasa” muda, jaringan tali pusat dan plasenta yang merupakan sumber MSC manusia yang sangat baik, dan jaringan ini biasanya dibuang saat lahir. Keputusan untuk menggunakan MSC autologus dari sumsum tulang atau adiposa, atau jaringan sumber alogenik untuk mengisolasi MSC adalah keputusan klinis yang mendasar, tetapi keduanya telah menunjukkan keberhasilan dalam menghasilkan MSC dalam jumlah besar (Pittenger dkk., 2019).
Isolasi Mesenchymal Stem Cell
MSCS adalah sel progenitor multipotensi dewasa dengan potensi pembaruan diri dan kemampuan untuk berdiferensiasi menjadi berbagai jenis sel khusus. Karena tidak ada satu pun biomarker yang tersedia untuk mengidentifikasi MSC manusia (hMSC), serangkaian penanda dan karakteristik sel telah diusulkan pada tahun 2006 oleh International Society for Cellular Therapy. Kriteria minimal MSC ini masih diterima secara luas saat ini dan mencakup (i) kemampuan untuk memperbarui diri, (ii) multipotensi dengan potensi osteogenik, kondrogenik, dan adipogenik, dan (iii) ekspresi serangkaian penanda permukaan yang khas atau cell surface markers, seperti cluster of differentiation (CD)73, CD90, dan CD105, sementara tidak ada ekspresi CD14, CD34, CD45, dan human leukocyte antigen-DR (HLA-DR).
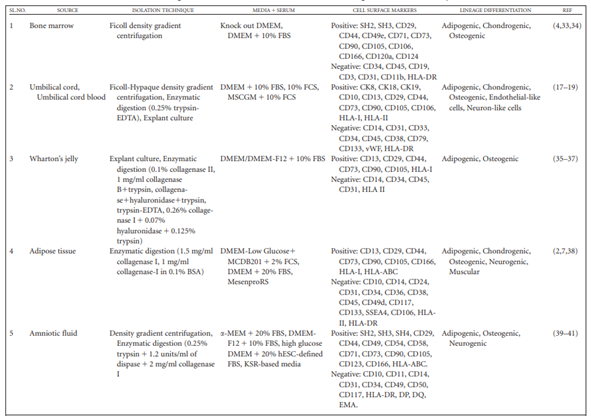
Tabel 1a. Fitur biologis MSC yang diisolasi dari sumber berbeda menggunakan teknik isolasi berbeda (Mushahary dkk., 2017)
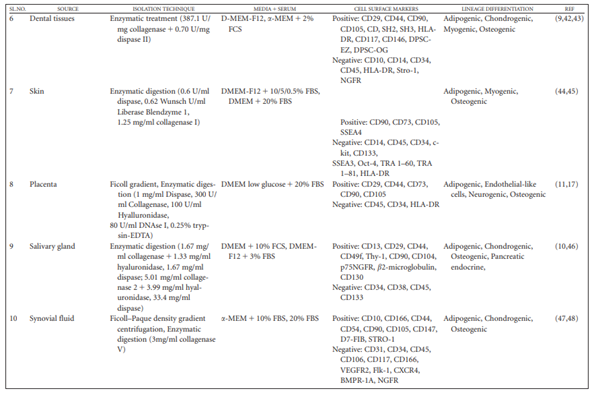
Tabel 1b. Fitur biologis MSC yang diisolasi dari sumber berbeda menggunakan teknik isolasi berbeda (Mushahary dkk., 2017)
Salah satu teknik paling awal untuk isolasi dan kultur sel in vitro adalah kultur eksplan (Gambar 2a). Jaringan sumber dibilas untuk membuang sel darah lalu dibelah secara mekanis (misalnya, dipotong atau dicacah) menjadi potongan-potongan kecil dengan panjang tidak lebih dari beberapa milimeter. Mengurangi ukuran potongan jaringan akan meningkatkan difusi gas dan nutrisi ke sel. Namun, pemotongan yang berlebihan dapat menyebabkan kerusakan mekanis pada sel. Potongan jaringan kemudian ditempatkan ke dalam wadah kultur plastik dengan media pertumbuhan. MSC tumbuh dari potongan jaringan ke permukaan cawan kultur. Setelah beberapa hari, potongan jaringan dapat disingkirkan. Protokol enzimatik (Gambar 2b) terdiri dari langkah-langkah tambahan di mana jaringan yang dicincang kasar diinkubasi dengan larutan enzim yang mendegradasi matriks ekstraseluler (ECM). Sel tunggal atau agregat seluler kecil dilepaskan dari jaringan dan dipindahkan ke media yang berisi cawan kultur.
Metode eksplan dilaporkan menghasilkan populasi sel yang kurang heterogen yang menunjukkan tingkat proliferasi dan viabilitas sel yang lebih tinggi jika dibandingkan dengan metode enzimatik. Hal ini dapat disebabkan oleh adanya potongan jaringan utuh dan ECM yang tidak terdisosiasi selama kultur eksplan, yang menjaga sel terlindungi dari stres proteolitik dan mekanis dan karenanya menyediakan lingkungan yang baik bagi sel yang bermigrasi.
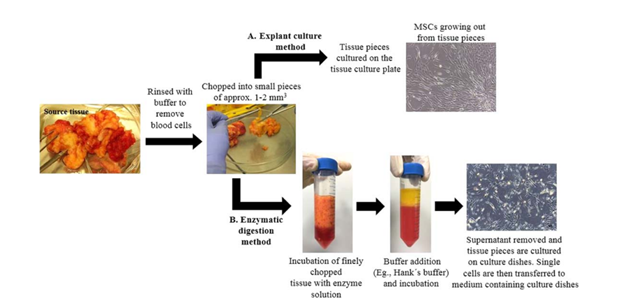
Gambar 2. Gambar representatif yang menunjukkan langkah-langkah isolasi MSC dengan (A) metode kultur eksplan dan (B) metode enzimatik (Mushahary dkk., 2017)
Keuntungan lebih lanjut dari kultur eksplan terletak pada pelepasan sitokin dan faktor pertumbuhan ke dalam medium, hasil sel stroma yang lebih tinggi, waktu proliferasi yang lebih singkat, dan ekspresi simultan cell surface markers CD73, CD90, dan CD105, serta tidak adanya CD14, CD31, CD34, dan CD45 di semua populasi MSC. Dengan adanya pengetahuan tentang cell surface markers, peneliti dapat mengisolasi Mesenchymal Stem Cells (MSC) dari berbagai jaringan atau organ dengan menggunakan Flow Cytometry (FCM) sebagai salah satu teknik yang efektif karena memungkinkan identifikasi dan pemurnian sel berdasarkan ekspresi marker permukaan sel spesifik.
Berikut adalah langkah-langkah umum untuk mengisolasi MSC dari beberapa jaringan atau organ menggunakan FCM:
Langkah-langkah untuk Mengisolasi MSC Menggunakan FCM
- Persiapan Sampel
Pemilihan Sumber Jaringan
MSC dapat diisolasi dari berbagai sumber jaringan, seperti sumsum tulang (bone marrow), jaringan adiposa (adipose tissue), darah tali pusat (umbilical cord blood), dan jaringan kelenjar seperti sinus, hati atau jaringan lain.Persiapan Jaringan
Jaringan yang diperoleh harus diolah menjadi suspensi sel tunggal. Ini dapat dilakukan dengan cara a) Enzimatis dengan menggunakan enzim seperti kolagenase untuk memecah jaringan menjadi suspensi sel atau b) Mekanik dengan menggunakan pipet atau alat mekanik lainnya untuk menumbuk dan memecah jaringan. - Penyaringan dan Pembersihan Sel
Penyaringan
Setelah jaringan dipecah, suspensi sel akan disaring melalui saringan mesh (biasanya 70 atau 40μ) untuk menghilangkan fragmen jaringan besar dan mendapatkan suspensi sel yang lebih bersih.Centrifugation
Selanjutnya, suspensi sel dapat diputar menggunakan sentrifugasi untuk memisahkan sel-sel yang lebih berat dari cairan media. - Pewarnaan Sel dengan Antibodi
Pemilihan Marker MSC
Gunakan panel antibodi fluoresen yang dikenali oleh Flow Cytometer untuk menandai sel MSC berdasarkan marker permukaan sel mereka, informasi marker permukaan sel atau cell surface markers dapat dilihat pada Tabel 1a dan 1b.|
taining Protocol
Suspensi sel dicampur dengan antibodi fluoresen yang sesuai dengan markernya dan inkubasi selama waktu yang disarankan oleh protokol (biasanya sekitar 30-60 menit pada suhu 4°C). - Persiapan untuk Flow Cytometry (FCM)
Pencucian Sel
|Setelah pewarnaan, sel-sel dicuci dengan buffer PBS atau buffer pengenceran lain untuk menghilangkan antibodi yang tidak terikat dan sisa-sisa reagen.Penyusunan Sel
Suspensi sel yang sudah dicuci akan disiapkan dalam jumlah yang tepat untuk analisis FCM, dengan konsentrasi yang sesuai agar aliran sel bisa dianalisis dengan akurat. Dalam tahap ini biasanya dilakukan perhitungan sel baik secara manual ataupun otomatis. - Analisis Flow Cytometry
Pemilihan Filter dan Deteksi Fluoresensi
Pilihlah filter yang sesuai pada flow cytometer untuk mendeteksi sinyal fluoresensi yang dihasilkan oleh antibodi yang terikat pada marker spesifik.Pengaturan Parameter
Sesuaikan parameter seperti forward scatter (FSC) dan side scatter (SSC) untuk memisahkan sel-sel berdasarkan ukuran dan kompleksitasnya.Pengumpulan Data
Analisanya akan memberikan informasi tentang persentase sel yang positif terhadap marker spesifik. Biasanya, MSC akan positif untuk CD73, CD90, dan CD105, dan negatif untuk marker hematopoietik seperti CD34 dan CD45. - Isolasi MSC dengan FCM
Setelah pemisahan berdasarkan ekspresi marker melalui FCM, selanjutnya dapat melakukan pemisahan sel dengan menggunakan cell sorter pada flow cytometer yang dilengkapi dengan kemampuan pemisahan sel berdasarkan ekspresi marker. Sel MSC yang teridentifikasi dapat dipisahkan dan dikumpulkan secara langsung.
Produk Elabscience
Elabscience menawarkan produk untuk isolasi sel MCS dengan flow cytometry. Berikut adalah beberapa produk Elabscience yang dapat digunakan.
| Nomor Katalog | Nama Produk |
| PB180327 | Phosphate Buffer (PBS |
| E-CK-A107 | Cell Staining Buffer |
| E-AB-F1236A | Purified Anti-Human CD16 Antibody |
| E-AB-F09792D | PE Mouse IgG1, κ Isotype Control[MOPC-21] |
| E-AB-F09792E | APC Mouse IgG1, κ Isotype Control[MOPC-21] |
| E-AB-F1167D | PE Anti-Human CD90 Antibody[5E10] |
| E-AB-F1167C | FITC Anti-Human CD90 Antibody[5E10] |
| E-AB-F1167E | APC Anti-Human CD90 Antibody[5E10] |
| E-AB-F1310E | APC Anti-Human CD105 Antibody[SN6] |
| E-AB-F1310D | PE Anti-Human CD105 Antibody[SN6] |
| E-AB-F1242C | FITC Anti-Human CD73 Antibody[AD2] |
| E-AB-F1143C | FITC Anti-Human CD34 Antibody[581] |
| E-AB-F1143D | PE Anti-Human CD34 Antibody[581] |
| E-AB-F1143E | APC Anti-Human CD34 Antibody[581] |
| E-AB-F1137E | APC Anti-Human CD45 Antibody[HI30] |
| E-AB-F1137I | PE/Cyanine5.5 Anti-Human CD45 Antibody[HI30] |
| E-AB-F1137F | PerCP Anti-Human CD45 Antibody[HI30] |
| E-AB-F1137P | PE/Elab Fluor® 594 Anti-Human CD45 Antibody[HI30] |
| E-AB-F1137C | FITC Anti-Human CD45 Antibody[HI30] |
Untuk pertanyaan produk dan stock lebih lanjut Bapak/Ibu dapat menghubungi kami PT. Indogen melalui email sales@indogen.id atau melalui WhatsApp berikut untuk fast respon WhatsApp Indogen.
Referensi :
Mushahary, D., Spittler, A., Kasper, C., Weber, V. and Charwat, V. (2018), Isolation, cultivation, and characterization of human mesenchymal stem cells. Cytometry, 93: 19-31. https://doi.org/10.1002/cyto.a.23242
Pittenger, M.F., Discher, D.E., Péault, B.M. et al. Mesenchymal stem cell perspective: cell biology to clinical progress. npj Regen Med 4, 22 (2019). https://doi.org/10.1038/s41536-019-0083-6
Artikel Terkait
- https://indogen.id/bagaimana-cara-isolasi-karakterisasi-dan-proliferasi-sel-kanker-payudara-menggunakan-flow-cytometry/
- https://indogen.id/isolasi-dan-identifikasi-sel-t-helper-perifer-tph-dengan-flowcytometry/
- https://indogen.id/prosedur-isolasi-sel-t-regulatory-t-reg-menggunakan-antibodi-elabscience/

