Mengenal Praktek dan Prosedur Teknik Imunofluoresensi (IF)
Teknik Imunofluoresensi (IF) adalah prosedur dengan berbagai langkah, dimulai dari penempelan sampel pada slide, fiksasi untuk mengawetkan sel dan jaringan, permeabilisasi sel untuk antigen intraseluler, inkubasi dan pencucian berulang serta yang terakhir mounting untuk pencitraan. Penting untuk diketahui bahwa tidak ada protokol universal untuk pencitraan IF. Pengujian dan pengoptimalan diperlukan untuk mengetahui kondisi optimal untuk setiap kombinasi antibodi, protein, dan spesimen. Protokol persiapan sampel mungkin juga perlu dioptimalkan untuk setiap percobaan.
A. Persiapan Sampel Biologis untuk Imunofluoresensi
IF dapat dilakukan pada cell line dan sel primer dalam kultur 2D, spheroid dalam kultur 3D serta sampel jaringan. Tujuan utama dari langkah awal ini adalah untuk memfasilitasi perlekatan spesimen ke permukaan padat yang cocok secara optik untuk memfasilitasi pencitraan.
1. Sel Primer dan Cell Line Ditumbuhkan di Cawan Petri
Sel dapat dibiakkan pada coverslip atau pada slide multi-well. Jika menggunakan coverslip, ketebalan coverslip dapat berdampak signifikan pada intensitas dan kualitas gambar. Coverslip #1.5 dengan ketebalan 170μm umumnya kompatibel dengan sebagian besar mikroskop. Coverslip dapat disterilkan dengan paparan sinar UV selama 30 menit sebelum kultur sel. Untuk sel yang tidak mudah menempel pada coverslip, kaca penutup dapat diinkubasi dalam 50µg/mL L-polylysine untuk memfasilitasi penempelan sel. Sel juga dapat langsung dibiakkan dalam slide multi-well.
Kelebihan coverslip adalah hanya memerlukan volume pengenceran antibodi yang lebih rendah, namun coverslip cukup rapuh dan harus ditangani dengan hati-hati selama pencucian berulang. Slide multi-well lebih kuat dan dapat menampung banyak sampel pada satu slide tetapi membutuhkan volume antibodi yang lebih besar untuk inkubasi. Sel yang dikultur kemudian dicuci dengan (1x) PBS untuk membilas media kultur sel sebelum melanjutkan ke fiksasi. Saat menggunakan alkohol sebagai fiksatif, sampel harus dikeringkan dengan udara sebelum fiksasi.
2. Sel Ditumbuhkan dalam Kultur Suspensi
Sel yang dikultur dalam suspensi dapat dilapisi sebagai monolayer pada slide dengan teknik sitospin. Sekitar 150–200μL sel yang tersuspensi dalam (1X) PBS dilapisi ke slide mikroskop dengan memutar pada kecepatan rendah untuk menempelkan sel ke slide. Slide dapat ditambahkan dengan L-polylysine untuk memfasilitasi perlekatan sel. Slide kemudian dikeringkan dengan udara sebelum melanjutkan ke fiksasi.
3. Sel Ditumbuhkan dalam Matriks Semi-Padat
Pencitraan IF sel yang tumbuh di matrigel, bagian bawah slide multi-well ditutupi dengan lapisan tipis matrigel untuk mencegah perlekatan sel ke bagian bawah pelat. Sel-sel tersebut kemudian dikultur dalam media yang dilengkapi matrigel untuk membentuk struktur 3D terpolarisasi. Media cair perlu dihilangkan sebelum fiksasi dilakukan.
4. Sampel Jaringan Manusia atau Hewan
Sampel jaringan perlu dipotong menjadi bagian tipis dan ditempelkan pada slide pencitraan. Jaringan diperoleh harus dibekukan atau difiksasi sebelum dimasukkan ke dalam parafin. Untuk jaringan beku, jaringan dibekukan secara cepat (snap-frozen) untuk menghindari pembentukan kristal air. Jaringan yang baru dibedah ditempatkan pada tissue mold yang telah dilabeli dan ditutup dengan media cryo-embedding (OTC) dan diletakkan di atas dry ice. Sampel dapat disimpan dalam nitrogen cair atau freezer suhu -80°C. Blok kemudian dipotong menjadi sekitar 6–8μm bagian dan dilampirkan ke slide.
Untuk embedding parafin, jaringan difiksasi biasanya dalam NBF dalam satu malam dan kemudian embedding dalam parafin. Blok parafin kemudian dipotong menjadi bagian berukuran 4–8μm dan ditempelkan pada slide kaca. Potongan dideparafinisasi dengan beberapa pencucian xilena diikuti dengan hidrasi melalui pencucian alkohol bertingkat. Karena fiksasi formalin dan embedding parafin dapat menutupi antigen, sampel dapat diberikan antigen unmasking dengan perlakuan panas (direkomendasikan) ataupun perlakuan pepsin atau saponin.
B. Fiksasi Sampel
Fiksasi merupakan langkah penting yang diperlukan untuk pencitraan IF yang optimal. Fiksasi sampel diperlukan untuk menghentikan proses degeneratif akibat hilangnya suplai darah atau media nutrisi, selain juga mempertahankan arsitektur seluler semirip mungkin dengan keadaan aslinya. Suatu fiksatif mungkin dapat merusak situs antigen sehingga proses fiksasi mungkin perlu dioptimalkan untuk setiap kombinasi antibodi-antigen. Berdasarkan sampel yang akan dianalisis, terdapat pilihan fiksatif yang berbeda.
a. Metanol
Untuk fiksasi metanol, sel ditutup dengan lapisan tipis dingin es 100% metanol dan diinkubasi pada suhu -20°C selama sekitar 15 menit. Metanol kemudian diaspirasi dan residu metanol dihilangkan dengan tiga kali pencucian dengan (1Xx PBS. Ini adalah metode sesuai untuk pewarnaan protein sitoskeletal. Fiksasi metanol dapat mengganggu ikatan hidrofobik dan lebih efektif untuk pewarnaan dengan antibodi monoklonal yang mengenali epitop yang biasanya terkubur dalam struktur protein internal. Selain itu, fiksasi metanol menurunkan kelarutan protein dan tidak cocok dalam pewarnaan protein lipid. Penurunan kelarutan protein juga menyebabkan pemipihan sel sehingga lebih sulit untuk mewarnai protein yang terlokalisasi pada nukleus atau mitokondria.
b. Aseton
Sampel ditutup dengan lapisan tipis aseton dingin es dan diinkubasi pada suhu -20°C selama 3-20 menit. Fiksasi aseton lebih efektif dalam mempertahankan integritas antigen dibandingkan dengan metanol dan dapat digunakan sebagai fiksatif jika fiksasi metanol tidak efektif. Aseton juga biasanya digunakan sebagai fiksatif untuk pewarnaan protein sitoskeletal. Fiksasi aseton sangat efektif pada permeabilisasi sel tetapi memiliki keterbatasan sama dengan fiksasi metanol. Fiksasi aseton umumnya merupakan metode pilihan untuk jaringan beku.
Catatan: Jika metanol atau aseton tidak efektif, sampel dapat difiksasi dengan campuran larutan aseton/metanol 1:1 dengan menginkubasi sampel selama sekitar 10 menit pada suhu -20°C. Jika menggunakan alkohol sebagai fiksatif, langkah permeabilisasi dapat dilewati.
c. Paraformaldehyde
Fiksasi paraformaldehyde (formaldehida terpolimerisasi) biasanya digunakan untuk pewarnaan protein membran. Fiksasi paraformaldehyde menghasilkan crosslinking gugus amino bebas, membentuk network luas berbagai interaksi yang mempertahankan arsitektur seluler secara lebih baik. Sampel difiksasi dalam larutan paraformaldehyde 2–4% baru (dalam 1x PBS) selama 15 menit pada suhu kamar. Proses ini diikuti dengan tiga kali pencucian masing-masing selama 5 menit dengan (1x) PBS yang mengandung glisin 100 nm.
Catatan: Paraformaldehyde umumnya merupakan fiksatif pilihan saat mewarnai sel dalam kultur 3D.
d. Formalin
Formalin adalah larutan formaldehida jenuh 37% yang dilarutkan dalam air. Penting untuk diketahui bahwa larutan formalin 10% setara dengan larutan paraformaldehyde 4%. Sampel difiksasi dalam formalin 1% dalam (1x) PBS selama 10 menit pada suhu kamar diikuti dengan tiga kali pencucian selama 5 menit masing-masing dengan (1x) PBS.
Catatan: Fiksasi dengan paraformaldehyde atau formalin dapat menyebabkan artefak dimediasi auto-fluoresensi sehingga penting untuk memiliki sampel kontrol yang tidak diinkubasi dengan antibodi primer untuk menentukan sinyal latar nonspesifik saat menguji setiap kombinasi antibodi-antigen. Pada IF tidak langsung, sampel kontrol harus diinkubasi hanya dengan antibodi sekunder. Fiksatif berbasis aldehid tidak efektif dalam permeabilisasi membran sel dan sampel perlu dipermeabilisasi sebelum pewarnaan untuk molekul biologis intraseluler.
C. Permeabilisasi Membran Sel
Permeabilisasi dapat mengganggu membran sel yang memungkinkan antibodi mengikat antigen intraseluler pada sel terfiksasi. Fiksatif seperti aseton dapat memperbaiki sekaligus permeabilisasi sel sementara fiksatif lainnya tidak terlalu efektif dalam permeabilisasi. Pewarnaan IF untuk markers pada permukaan sel, permeabilisasi akan merusak membran sel sehingga tidak direkomendasikan. Deterjen seperti SDS, Triton X-100, Tween-20, dan saponin biasanya digunakan untuk permeabilisasi serta harus dioptimalkan sedemikian rupa sehingga fiksasi dan permeabilisasi menghasilkan distorsi morfologi seluler yang minimal. Permeabilisasi dengan 1% triton X-100 selama 1–5 menit pada suhu kamar diikuti dengan pencucian (1x) PBS adalah metodologi yang umum digunakan untuk permeabilisasi sampel.
Catatan: Langkah permeabilisasi dapat dilewati jika protein yang akan diwarnai terdapat pada membran sel atau jika aseton digunakan untuk fiksasi. Untuk mendapatkan sinyal tertentu, disarankan untuk menggunakan deterjen paling lembut untuk penetrasi antibodi. Untuk meningkatkan efisiensi permeabilisasi deterjen yang umum digunakan adalah saponin, Tween-20, triton X-100, dan SDS.
D. Blocking untuk Membatasi Interaksi Antibodi Nonspesifik
Pewarnaan IF dapat ditingkatkan dengan melakukan blocking interaksi nonspesifik antibodi primer dan sekunder dengan sampel. Pengikatan nonspesifik dapat terjadi akibat pengikatan antibodi yang tidak sesuai dengan molekul non-antigen oleh kelebihan aldehid yang tidak bereaksi, terperangkapnya antibodi dalam struktur hidrofobik ataupun oleh pengikatan antibodi poliklonal berafinitas rendah pada molekul nonspesifik. Menginkubasi sampel dalam larutan protein sebelum inkubasi dengan antibodi primer mencegah interaksi nonspesifik ini. Sampel diinkubasi dengan blocking agents seperti BSA, susu atau serum.
Catatan: Serum umumnya merupakan reagen pilihan untuk pewarnaan IF. Penting untuk dicatat bahwa blocking serum harus diperoleh dari spesies yang berbeda dari spesies antibodi primer berasal. Jika melakukan IF tidak langsung, blocking serum harus termasuk dalam spesies antibodi sekunder berasal. Karena banyak antibodi sekunder berasal dari kambing, serum kambing adalah pilihan umum untuk langkah blocking.
Untuk blocking, inkubasi sampel dalam larutan serum 5% (dalam 1x PBS dengan 0,05% Tween-20 atau 0,05% Triton X-100) selama 30 menit hingga satu jam. Blocking buffer yang tersedia secara komersial yang mengandung protein tunggal yang sangat murni atau senyawa bebas protein yang dipatenkan juga dapat digunakan untuk blocking.
E. Inkubasi dengan Antibodi Primer
Setelah blocking, sampel kemudian siap untuk diinkubasi dengan antibodi primer. Antibodi primer yang baik dengan afinitas tinggi terhadap antigen dan spesifisitas baik sangat penting untuk mendapatkan gambar berkualitas tinggi yang dapat dipercaya dan oleh karena itu perlu dilakukan pengujian beberapa antibodi terhadap antigen yang sama. Antibodi primer diencerkan dalam blocking buffer dan kemudian disebarkan ke sampel. Antibodi diencerkan 1:100–1:10000 (atau di luar kisaran ini) bergantung pada kelimpahan antigen, konsentrasi antibodi, dan afinitas antibodi terhadap antigen. Pengenceran antibodi perlu dioptimalkan untuk mendapatkan gambar berkualitas baik. Saat pewarnaan untuk berbagai protein, antibodi primer dapat digabungkan asalkan berasal dari spesies yang berbeda dan kemudian ditambahkan ke sampel.
Sampel dapat diinkubasi dengan antibodi primer selama satu jam pada suhu kamar atau semalaman pada suhu 4°C atau kombinasi keduanya. Antibodi primer yang tidak terikat dihilangkan dengan beberapa kali pencucian dengan (1x) PBS yang mengandung 0,05% Tween-20 atau 0,05% Triton X-100. Selalu berhati-hati untuk memastikan bahwa sampel tidak mengering di antara semua langkah. Jika melakukan IF langsung, dapat melanjutkan ke mounting dan pencitraan.
Catatan: Untuk menghindari pengikatan nonspesifik, antibodi primer harus berasal dari spesies yang berbeda dari spesies yang sedang dipelajari.
F. Inkubasi dengan Antibodi Sekunder
Antibodi sekunder terkonjugasi fluorofor diencerkan (1:200–1:500) dalam blocking buffer dan ditambahkan ke sampel. Sampel dapat diinkubasi dengan antibodi sekunder selama satu jam pada suhu kamar atau semalaman pada suhu 4°C. Berdasarkan pengalaman, konjugat antibodi sekunder Alexa Fluor bersifat cerah dan stabil serta menunjukkan spesifisitas yang baik. Setelah inkubasi dengan antibodi sekunder, sampel dicuci tiga kali dengan (1x) PBS yang mengandung 0,05% Tween-20 atau 0,05% Triton X-100 untuk menghilangkan kelebihan antibodi sekunder yang tidak terikat. Pastikan sampel tidak mengering di antara setiap langkah.
Catatan: Saat pewarnaan dengan beberapa antibodi primer, antibodi sekunder yang sesuai perlu dikonjugasikan ke fluorofor berbeda yang tidak tumpang tindih dalam spektrum eksitasi dan emisinya.
G. Mounting
Setelah inkubasi dengan antibodi sekunder, sampel dicelupkan ke dalam akuades untuk menghilangkan kelebihan garam yang dapat menghasilkan residu setelah pengeringan. Setelah menghilangkan kelebihan air dengan penyerapan tisu Kim, sedikit mounting medium yang cukup untuk menutupi sampel ditambahkan sebelum menutupi sampel dengan kaca penutup. Sampel kemudian dibiarkan mengering pada permukaan yang rata dan ujung-ujungnya ditutup dengan nail polish. Mounting media mempertahankan sampel dan meningkatkan indeks bias untuk mendapatkan gambar berkualitas tinggi dengan lensa imersi minyak. Selain itu, mounting media yang tersedia secara komersial seperti Prolong Gold dari Molecular Probe dan Fluoro-Mount-G (anti-fade) meminimalkan photobleaching karena adanya scavenger radikal bebas. Mounting media juga mengandung DAPI (4ʹ,6-diamidino-2-phenylindole) yaitu fluorofor yang dapat berinteraksi dengan DNA yang memancarkan cahaya spektrum biru dan umumnya digunakan untuk memvisualisasikan inti. Setelah mounting, sampel siap untuk pencitraan.
Catatan: Setelah mounting, sampel harus disimpan pada suhu -20° hingga pencitraan untuk mempertahankan sinyal fluoresensi.
H. Pencitraan
Setelah pewarnaan IF, antigen yang diinginkan dapat divisualisasikan dengan mikroskop fluoresensi atau mikroskop confocal tergantung pada penelitian. Mikroskop fluoresensi biasanya digunakan untuk melihat ekspresi tetapi bukan untuk menglokalisasi antigen yang berbeda. Mikroskop confocal mampu menunjukkan dua atau lebih protein berkolokasi. Mikroskop confocal memanfaatkan teknik pencitraan yang menangkap gambar dengan resolusi optik tinggi di bidang confocal dengan menghilangkan cahaya yang tidak fokus. Gambar yang diambil pada beberapa bidang confocal dapat diintegrasikan untuk menghasilkan gambar 3D.
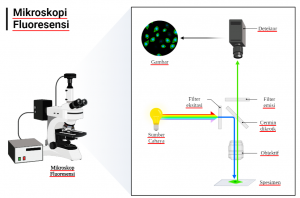
Gambar 1. Pencitraan dengan Mikroskop Fluoresens
I. Kontrol dan Pertimbangan Penting
Kualitas pewarnaan IF mungkin terhalang oleh ikatan nonspesifik dari antibodi primer atau sekunder yang menghasilkan sinyal nonspesifik. Penggunaan kontrol yang tepat sangat penting untuk memvalidasi pengikatan spesifik dari antibodi primer atau sekunder. Untuk menguji spesifisitas antibodi primer, pewarnaan IF harus dilakukan baik dengan memblokir antibodi primer dengan peptida/protein atau dengan memverifikasi kurangnya sinyal dalam sampel dengan penghapusan yang ditargetkan atau pembungkaman yang dimediasi interferensi RNA dari target kepentingan.
Untuk mengatasi masalah pewarnaan nonspesifik dengan antibodi sekunder, kurangnya sinyal perlu dikonfirmasi dalam sampel sekunder saja yang diinkubasi hanya dengan antibodi sekunder dan tidak diinkubasi dengan antibodi primer. Masalah dengan spesifisitas antibodi dapat diatasi dengan mengoptimalkan proses fiksasi dan blocking atau menggunakan antibodi afinitas tinggi spesifik yang berbeda terhadap target yang diinginkan.
Pilihan fluorofor yang digunakan untuk pencitraan IF juga sangat penting untuk mendapatkan gambar IF berkualitas baik. Fluorofor yang ideal menunjukkan fluoresensi cerah, memiliki fotostabilitas tinggi, dan fluoresensinya tidak diubah oleh faktor eksternal seperti konjugasi antibodi atau perubahan pH. Selain itu, fluorofor harus memiliki puncak eksitasi pada panjang gelombang eksitasi yang tersedia pada mikroskop fluoresensi dan spektrum emisi sempit yang dapat dideteksi secara khusus oleh mikroskop fluoresensi.
Tabel 1. Reagen Terkait Imunofluoresensi (IF) dari Elabscience
| Katalog | Deskripsi Produk | Aplikasi | Ukuran |
| E-IR-R321 | Immunol Fluorescence Staining Kit(Anti-Rabbit IgG-Cy3) | IF kit | 50T/100T/200T |
| E-IR-R322 | Immunol Fluorescence Staining Kit(Anti-Mouse IgG-Cy3) | IF kit | 50T/100T/200T |
| E-IR-R323 | Immunol Fluorescence Staining Kit(Anti-Rabbit IgG-FITC) | IF kit | 50T/100T/200T |
| E-IR-R324 | Immunol Fluorescence Staining Kit(Anti-Mouse IgG-FITC) | IF kit | 50T/100T/200T |
| E-IR-R325 | Immunol Fluorescence Staining Kit(Anti-Rabbit IgG-AF488) | IF kit | 50T/100T/200T |
| E-IR-R326 | Immunol Fluorescence Staining Kit(Anti-Mouse IgG-AF488) | IF kit | 50T/100T/200T |
| E-IR-R327 | Immunol Fluorescence Staining Kit(Anti-Rabbit IgG-AF594) | IF kit | 50T/100T/200T |
| E-IR-R328 | Immunol Fluorescence Staining Kit(Anti-Mouse IgG-AF594) | IF kit | 50T/100T/200T |
| E-IR-R113 | 4% Paraformaldehyde (without DEPC) | Fixation | 100mL/500mL/1L |
| E-IR-R114 | 4% Paraformaldehyde (with DEPC) | Fixation | 100mL/500mL/1L |
| E-IR-R104 | 10× Antigen Retrieval Solution pH 9.0 for IHC | Retrieval | 100mL/500mL/1L |
| E-IR-R105 | 10× Antigen Retrieval Solution pH 6.0 for IHC | Retrieval | 100mL/500mL/1L |
| E-IR-R109 | Proteinase K | Permeabilization | 1mL/5mL/10mL |
| E-IR-R122 | Triton X-100 | Permeabilization | 10mL/50mL/100mL |
| E-IR-R107 | 5% BSA Blocking Buffer | Blocking | 5mL/10mL/50mL |
| E-IR-R108 | BSA | Blocking | 5g/10g/50g |
| E-IR-R110 | Normal Goat Serum (Ready-to-Use) | Blocking | 5mL/10mL/50mL |
| E-IR-R111 | 10× Normal Goat Serum | Blocking | 5mL/10mL |
| E-IR-R124 | Normal Rabbit Blocking Buffer (Concentrated) | Blocking | 5mL/10mL |
| E-IR-R128 | Normal Rabbit Blocking Buffer (Ready-to-Use) | Blocking | 5mL/10mL/50mL |
| E-IR-R106 | Antibody Dilution Buffer | Dilution | 10mL/50mL/100mL |
| E-IR-R103 | DAPI Reagent | Nuclear Staining | 5mL/10mL/50mL |
| E-IR-R119 | Anti-Fluorescence Quenching Agent | Mounting | 5mL/15mL/50mL |
| E-BC-R187 | PBS Buffer, pH7.4(10×) | Buffer | 100mL/500mL |
| E-BC-R335 | TBST Buffer (10×) | Buffer | 100mL/500mL |
| E-IR-R116 | 10×TBS(pH7.4) | Buffer | 100mL/500mL |
| E-IR-R310 | PBST Buffer, pH7.4 (10 ×) | Buffer | 500mL |
J. Referensi
- Betterle C, Zanchetta R. 2012. The immunofluorescence techniques in the diagnosis of endocrine autoimmune diseases. Autoimmune Highlights. 3(2):67-78.
- Fincham REA, Bashiri H, Lau MC, Yeong J. 2022. Editorial: Multiplex Immunohistochemistry/Immunofluorescence Technique: The Potential and Promise for Clinical Application. Front Mol Biosci. 9:831383.
- Jalali M, Saldanha FYL, Jalali M. 2017. Basic Science Methods for Clinical Researchers. Academic Press.
- Shojaeian S, Maslehat Lay N and Zarnani A-H. 2020). Detection Systems in Immunohistochemistry. Immunohistochemistry – The Ageless Biotechnology. IntechOpen.
K. Artikel Terkait
1. Introduksi Flow Cytometer dan Prinsip Kerjanya [Link]
2. Bagaimana Memilih Antibodi untuk Flow Cytometry [Link]
3. Aplikasi Metode Flow Cytometry dan Perkembangan Jenis Assay [Link]
4. Prosedur Flow Cytometry dan Seleksi Jenis Antibodi Flow Cytometry [Link]
5. IHC 1: Ready-to-Use Antibodies untuk IHC merk Elabscience® [Link]
6. IHC 2 : Panduan Imunohistokimia (IHK) untuk Preparat Paraffin [Link]
7. Memilih Antibodi Primer atau Sekunder [Link]
8. 6 Alasan Memilih Kit Deteksi Apoptosis Annexin V Merk Elabscience® [Link]
9. 5 Alasan Memilih Kit TUNEL Assay Merk Elabscience® [Link]

