Introduksi Flow Cytometer dan Prinsip Kerjanya
A. Flow Cytometry dan Flow Cytometer
Flow cytometry adalah teknologi yang mengukur dan kemudian menganalisis berbagai karakteristik fisik partikel tunggal, biasanya berupa sel saat mereka mengalir dalam aliran fluida melewati sorotan sinar. Sifat-sifat yang diukur meliputi ukuran relatif partikel, granularitas relatif, kompleksitas internal dan intensitas fluoresensi relatif. Karakteristik ini ditentukan dengan menggunakan sistem kopling optik-ke-elektronik yang merekam bagaimana sel atau partikel menaburkan sinar laser insiden dan memancarkan fluoresensi. Selain sel, tingkat ekspresi protein intraseluler, mRNA spesifik dan jumlah DNA total pada sel juga dapat diukur secara kuantitatif. Isolasi atau penyortiran jenis sel spesifik juga dapat dilakukan dengan instrumentasi FACS (Flow-Activated Cell Sorting) yang merupakan suatu tipe flow cytometry khusus.
Flow cytometer terdiri dari tiga sistem utama: fluidik, optik dan elektronik:
- Sistem fluidik mengangkut partikel dalam aliran ke sinar laser untuk proses interogasi.
- Sistem optik terdiri dari laser untuk menyinari partikel dalam aliran sampel dan filter optik untuk mengarahkan sinyal cahaya yang dihasilkan ke detektor yang sesuai.
- Sistem elektronik mengkonversi sinyal cahaya yang terdeteksi menjadi sinyal elektronik yang dapat diproses oleh komputer. Untuk beberapa instrumen yang dilengkapi dengan fitur penyortiran (FACS), yaitu sistem elektronik juga mampu melakukan penyortiran untuk memberikan muatan pada partikel dan mendefleksi partikel.
Pada flow cytometer, partikel diangkut ke intercept laser di dalam aliran fluida. Setiap partikel atau sel tersuspensi berukuran 1–15μm sesuai untuk dianalisis, namun, dengan sistem khusus sel dengan ukuran lebih kecil atau lebih besar juga dapat dianalisis. Ribuan sel (atau event) dapat dianalisis sekaligus dalam setiap detiknya. Sel-sel dari jaringan padat harus disegregasikan sebelum melakukan analisis. Bagian aliran fluida tempat partikel berada disebut sample core. Saat partikel melewati intercept laser, mereka akan menghamburkan sinar laser. Setiap molekul fluoresen yang berada pada partikel menjadi berpendar. Cahaya yang terhamburkan dan berpendar selanjutnya dikumpulkan oleh lensa yang diposisikan dengan tepat. Kombinasi pemisah sinar dan filter mengarahkan cahaya terhambur dan berpendar tersebut ke detektor spesifik. Detektor menghasilkan sinyal elektronik yang berbanding lurus dengan sinyal optik yang mengenai partikel atau sel.
a. Sistem Fluidik
Sistem fluidik memiliki fungsi untuk mengangkut partikel dalam aliran fluida ke sinar laser untuk diinterogasi. Pada pencahayaan optimal, aliran yang mengangkut partikel harus ditempatkan di tengah sinar laser. Hanya satu partikel atau sel yang harus bergerak melalui sinar laser pada saat tertentu. Untuk melakukan ini, sampel diinjeksikan ke aliran sheath fluid di dalam flow chamber. Flow chamber pada alat benchtop cytometer disebut flow cell, sedangkan flow chamber pada stream-in-air cytometer disebut nozzle tip. Desain flow chamber menyebabkan sample core difokuskan di tengah sheath fluid dimana sinar laser kemudian akan berinteraksi dengan partikel. Sample core akan tetap terpisah namun koaksial di dalam sheath fluid. Aliran sheath fluid mempercepat sekaligus membatasi partikel ke pusat sample core. Proses ini dikenal sebagai pemfokusan hidrodinamik (hydrodynamic focusing).
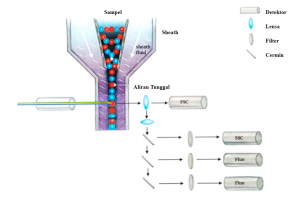
Gambar 1. Instrumentasi Flow Cytometer. Sampel diinjeksikan ke bagian tengah sheath fluid yang terdiri dari air
atau buffer. Desain seperti ini bertujuan untuk membatasi aliran sampel di tengah sheath fluid pada interrogation point. Saat sel melewati sinar laser, sinar dihamburkan (scattered). Forward scatter (FSC) dan side scatter (SSC) masing-masing memberikan informasi tentang ukuran dan kompleksitas sel. Misalnya, sel mati biasanya memiliki FSC lebih rendah daripada sel hidup. Neutrofil lebih granular daripada leukosit sehingga memiliki SSC yang lebih tinggi. Jika sel mengekspresikan protein fluoresen atau diwarnai dengan antibodi terkonjugasi fluorokrom, molekul fluoresen dieksitasi dan memancarkan sinar dengan panjang gelombang (warna) tertentu. Collection optic system terdiri dari lensa dan filter yang mengarahkan sinar yang dipancarkan ke detektor spesifik.
b. Sistem Optik
Sistem optik terdiri dari optik eksitasi dan optik koleksi. Optik eksitasi terdiri dari laser dan lensa yang digunakan untuk membentuk dan memfokuskan sinar laser. Optik koleksi terdiri dari lensa koleksi untuk mengumpulkan cahaya yang dipancarkan dari interaksi sinar laser dengan partikel serta sistem cermin optik dan filter untuk mengarahkan panjang gelombang spesifik dari cahaya yang dikumpulkan ke detektor optik yang tertuju.
Saat partikel sinar laser, cahaya disebarkan ke segala arah. Forward scatter (FSC) adalah cahaya yang tersebar ke arah depan dan mencerminkan ukuran sel. Cahaya tersebar di bagian samping mencerminkan granularitas dan kompleksitas internal sel yang disebut dengan side scatter (SSC).
Selain sifat fisik partikel atau sel, flow cytometry dapat mengukur intensitas emisi fluoresensi dari setiap sel ketika dilabeli dengan molekul fluoresen, contohnya antibodi terkonjugasi fluorokrom, protein fluoresen (GFP, YFP), DAPI (4′ ,6-diamidino-2-phenylindole) atau molekul lainnya.
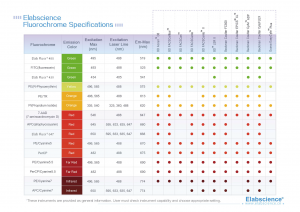
Gambar 2. Fluorophore untuk Flow Cytometry di Elabscience [Link]
c. Sistem Elektronik
Detektor yang mengumpulkan sinyal cahaya akan menghasilkan pulsa elektronik (tegangan pulsa) yang diproses oleh sistem elektronik. Tinggi, lebar, dan luas pulsa elektronik ditentukan oleh ukuran, kecepatan, dan intensitas fluoresensi sel. Data hasil analisis flow cytometry disimpan dalam format yang disebut Flow Cytometry Standard (FCS) yang dikembangkan oleh International Society for Advancement of Cytometry (ISAC).
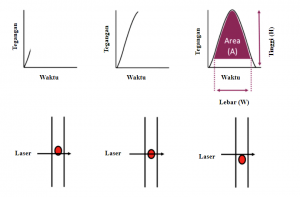
Gambar 3. Tegangan pulsa. Saat sel berlabel fluoresen mengalir melewati laser, sel menghamburkan cahaya dan memancarkan fluoresensi. Sinyal-sinyal ini diubah menjadi sinyal elektronik (pulsa voltase) oleh fotodetektor. Titik tertinggi dari pulsa mencerminkan titik hamburan cahaya atau fluoresensi maksimum yang dihasilkan dan terjadi ketika sel berada di pusat sorotan. Lebar pulsa menunjukkan waktu yang dibutuhkan sel untuk melewati sorotan dan berbanding lurus dengan ukurannya, sedangkan tinggi puncak mencerminkan intensitas sinyal dari sel. Tegangan pulsa diubah menjadi nilai digital dan kemudian ditampilkan pada plot data.
B. FACS (Flow-Activated Cell Sorting)
Beberapa cytometer juga dapat mengumpulkan (menyortir) sel yang diinginkan untuk analisis lebih lanjut. Cara paling umum untuk menyortir didasarkan pada defleksi dari tetesan bermuatan. Tetesan tersebut akan memutuskan aliran utama. Tetesan yang mengandung sel target kemudian akan bermuatan elektrostatis dan akan didefleksi ke kanan atau kiri ke dalam tabung spesifik. Penentuan jenis sel yang akan diisolasi didasarkan dengan FSC, SSC, dan intensitas fluoresensi channel manapun. Viabilitas sel setelah penyortiran sangat bergantung pada jenis sel, tetapi cukup banyak jenis sel yang kompatibel dengan sistem FACS dan dapat dikultur selanjutnya.
C. Pewarnaan Target Permukaan Sel untuk Flow Cytometry
Marker permukaan sel dapat digunakan untuk menentukan subset atau jenis sel berdasarkan tahap perkembangan untuk dianalisis dengan flow cytometry. Marker permukaan memiliki bentuk dan fungsi yang berbeda-beda. Misalnya, CD4 adalah marker permukaan untuk sel T helper yang dapat dibedakan lebih lanjut berdasarkan ekspresi reseptor kemokin lainnya dan marker kluster diferensiasi (cluster of differentiation, CD). Sel hidup yang diwarnai dengan antibodi dapat disortir berdasarkan pola pewarnaan unik-spesifik dan digunakan untuk eksperimen selanjutnya.
Prinsip dasar persiapan sampel untuk flow cytometry:
- Memastikan sampel sel segar: persiapan dan deteksi sampel harus diselesaikan sesegera mungkin.
- Pencucian sampel secara tepat: digesti enzim atau perlakuan EDTA harus diterapkan untuk sampel sel yang berbeda untuk menghilangkan impuritas dan desegregasi sel yang menempel satu dengan lainnya dalam suspensi sel tunggal.
- Digesti enzim, dispersi mekanik dan dispersi kimia dapat diterapkan pada jaringan tumor untuk mendapatkan suspensi sel tunggal
- Jaringan pada parafin harus dipotong menjadi irisan setebal 40~50 μm terlebih dahulu. Setelah dewaxing masukkan ke dalam air, suspensi sel tunggal dapat dibuat dengan prosedur di atas.
- Jumlah sel tunggal dalam suspensi tidak boleh kurang dari 107/mL.
Tahapan flow cytometry dapat dibagi menjadi lima langkah:
- Pengambilan sampel. memilih jaringan bedah atau biopsi spesifik. Sampel harus diperlakukan dalam waktu 1 jam pada suhu kamar atau diawetkan dalam waktu fiksatif atau pada suhu rendah.
- Pewarnaan sel dengan antibodi fluoresensi untuk mewarnai sel.
- Memasukan sampel untuk deteksi dan perolehan data dengan program software yang disediakan oleh alat.
- Analisis data secara kuantitatif.
- Evaluasi signifikansi biologis dan medis dari hasil analisis.
Referensi:
1. Hawley TS, Hawley RG. 2018. Flow Cytometry Protocols. Humana Press.
2. Ortolani C. 2022. Flow Cytometry Today: Everything You Need to Know about Flow Cytometry. Springer.
3. Jalali M, Saldanha FYL, Jalali M. 2017. Basic Science Methods for Clinical Researchers. Academic Press.
Related articles:
1. Bagaimana Memilih Antibodi untuk Flow Cytometry [Link]
2. 4 Metode Mengukur Proliferasi Sel [Link]
3. Cell Line Merk Elabscience [Link]
4. 6 Alasan Memilih Kit Deteksi Apoptosis Annexin V Merk Elabscience® [Link]
5. 4 Alasan Memilih Kit Cell Proliferation and Toxicity Merk Elabscience® [Link]
6. 5 Alasan Memilih Kit TUNEL Assay Merk Elabscience® [Link]

