Metode Molekuler Deteksi Kanker Darah dengan GenMark geneMAP™ RT-qPCR Kits
Istilah Penting:
- Sekuensing Sanger : teknik sekuensing bertarget dengan primer oligonukleotida untuk mencari wilayah DNA tertentu (sekuensing reguler).
- Mutasi “hotspot” : segmen DNA yang sangat rentan terhadap perubahan genetik
- Pyrosequencing : teknik sekuensing gen yang mengandalkan pembentukan (sintesis) untai komplementer dan pengamatan emisi cahaya untuk menganalisis urutan untai DNA. Teknik ini hanya terbatas pada sekuens kecil sepanjang 300-500 bp saja, tetapi merupakan teknik cepat dan ekonomis untuk menemukan lokasi mutasi gen dan menentukan metilasi DNA.
- Myeloid : sel darah yang berasal dari sumsum tulang, serta akan matang dan berdiferensiasi sebagai basofil, eosinofil, eritrosit, makrofag, monosit, neutrofil, atau trombosit.
- Blast : prekursor (sel imatur) dari sel darah dewasa seperti neutrofil, monosit, limfosit, dan eritrosit.
- Garis keturunan sel hematopoietik : kronologi perkembangan diferensiasi stem cell hematopoietik menjadi berbagai sel hematopoietik seperti trombosit, granulosit eritrosit, makrofag, dan limfosit.
- Allele burden : varian frekuensi alel
- Ruxolitinib : inhibitor Janus Associated Kinase (JAK), obat untuk mengobati myelofibrosis, PV (polisitemia vera) dan penyakit graft-versus-host akut yang tahan terhadap steroid.
- Dasatinib: obat untuk mengobati pasien leukemia myeloid kronis tertentu atau leukemia limfoblastik akut yang memiliki kromosom Philadelphia (Ph) positif.
Kanker Darah
Neoplasma hematopoetik, dikenal dengan kanker darah atau malignansi hematopoietik, yaitu jenis penyakit yang mempengaruhi produksi dan fungsi sel darah dalam aliran darah, sumsum tulang, kelenjar getah bening (nodus limfa), dan organ hematopoietik lainnya. Jenis utama kanker darah adalah leukemia, limfoma, dan mieloma. Berdasarkan asal sel tumor, neoplasma hematopoetik dapat dikategorikan sebagai neoplasma mieloid atau neoplasma limfoid.
Pengklasifikasian kanker darah diperoleh dengan menggabungkan data hematologi, morfologi, imunofenotipe, dan genetik molekuler. Pengujian molekuler umum meliputi analisis mutasi gen, deteksi fusi gen (translokasi dan inversi), dan uji klonalitas sel B/T. Pengujian tersebut dapat digunakan untuk diagnosis kanker, klasifikasi, prognosis, pengobatan dan monitoring minimal residual disease (MRD). Analisis molekuler chimerisme (analisis perbedaan genetik membedakan sel donor dari sel resipien) rutin juga sangat penting sejalan dengan peningkatan transplantasi stem cell alogenik dalam pengobatan neoplasma hematopoetik,
Analisis mutasi gen dilakukan dengan sekuensing gen tunggal (sekuensing Sanger), pyrosequencing (kasus mutasi titik “hot-spot” dalam satu gen), ataupun metode NGS dengan beberapa panel gen. Metode PCR kualitatif atau kuantitatif dapat digunakan untuk mendeteksi translokasi/inversi kromosom. Metode aCGH (array-based comparative genomic hybridization) dapat digunakan untuk skrining seluruh genom guna mendeteksi variasi jumlah salinan. Teknik FISH (fluorescence in situ hybridization) dapat diandalkan untuk diagnosis hampir semua leukemia dengan karakteristik translokasi/inversi kromosom karena PCR mampu menghasilkan hasil negatif palsu yang disebabkan heterogenitas chromosomal breakpoint. Analisis kariotipe konvensional rutin masih dapat digunakan untuk mendeteksi semua kasus neoplasma myeloid.
Dengan berkembangnya teknologi di Indonesia, teknologi NGS telah masuk ke dalam negeri dan ranah klinis karena kemajuan teknologi yang luar biasa sebagai platform sequencing yang cepat dan efisien. Namun demikian, masih terdapat beberapa keterbatasan yang signifikan dalam aspek klinis di Indonesia, termasuk dalam penanganan kasus kanker darah. Terlepas dari biaya yang relatif tinggi dan sumber daya manusia ahli yang terbatas, platform NGS memiliki akurasi rendah dan panjang short-read sequencing tetap menjadi masalah. Selain itu, NGS tidak dapat digunakan untuk mendeteksi varian langka karena tingkat error cukup tinggi dan tidak dapat menilai informasi dalam satu kali pembacaan. Hal ini membatasi penerapan klinis NGS dalam penentuan mutasi dengan kelimpahan rendah. Dengan demikian, strategi sekuensing tambahan (kombinasi) juga masih diperlukan untuk memperoleh hasil dengan akurasi tinggi sehingga akan meningkatkan biaya kembali dalam ranah klinis. Saat ini, metode konvensional seperti PCR, FISH dan metode lainnya masih menjadi kombinasi optimum dalam penanganan kasus malignansi hematologi.
Neoplasma Myeloid
Neoplasma myeloid adalah kelainan klonal yang muncul pada stem cell hematopoietik. Disorder ini terdiri dari Ph (Philadelphia chromosome)-positive chronic myeloid leukemia, Ph-negative myeloproliferative neoplasms (MPN), acute myeloid leukemia (AML) dan myelodysplastic / myeloproliferative neoplasm (MDS / MPN). Dengan kemajuan teknologi molekuler saat ini, pengujian molekuler berperan penting dalam diagnosis, klasifikasi, stratifikasi risiko, monitoring MRD dan terapi tertarget pada neoplasma myeloid.
Acute Myeloid Leukemia (AML)
AML adalah kelompok penyakit heterogen secara genetik yang ditandai dengan proliferasi klonal dari blast (sel imatur) garis keturunan myeloid dan gangguan hematopoiesis normal. Pasien AML dapat datang dari kasus AML langsung atau perkembangan dari MDS. AML dari MDS biasanya berhubungan dengan kariotipe kompleks, mutasi lebih somatik dan prognosis buruk.
Kelainan sitogenetik dan profil mutasi gen berperan penting dalam stratifikasi risiko. Skema WHO yang direvisi tahun 2016 mengenali subtipe AML berikut (t = translokasi, inv. = inversi):
- AML dengan t(8;21) (q22;q22.1)/RUNX1-RUNX1T1
- AML dengan inv.(16) (p13.1q22) atau t(16; 16)(p13.1;q22)/CBFB-MYH11
- leukemia promyelocytic akut dengan t(15;17)(q22;q21)/PML-RARA
- AML dengan t(9;11)(p21.3;q23.3 )/KMT2A-MLLT3
- AML dengan t(6;9)(p23;q34.1)/DEK-NUP214
- AML dengan inv. (3)(q21.3q26.2) atau t(3;3)(q21.3;q26.2)/GATA2-MECOM
- AML (megakarioblastik) dengan t(1;22)(p13.3;q13.1)/RBM15-MKL1
- AML dengan BCR-ABL1
Sebagian besar entitas yang termasuk dalam kategori ini melibatkan translokasi/inversi kromosom yang mengaktifkan faktor transkripsi atau jalur transduksi sinyal. Tiga kategori pertama tidak memerlukan perhitungan 20% blast pada sumsum tulang atau darah perifer untuk diagnosis AML, serta sering terjadi pada anak muda dan biasanya berhubungan dengan prognosis baik.
Fusi gen akibat translokasi/inversi ini dapat dideteksi dengan analisis kariotipe, FISH atau RT-PCR. Analisis kariotipe konvensional terkadang tidak mampu menskrining beberapa kelainan, khususnya inv.(16)(p13q22), sehingga metode FISH dan/atau RT-PCR kuantitatif perlu dilakukan. Metode RT-PCR kuantitatif dapat terus digunakan dalam monitoring MRD pada pasien AML setelah terapi dikarenakan sensitivitasnya cukup baik. Namun, untuk transkrip RUNX1-RUNX1T1 mungkin tetap tersisa bahkan setelah terapi sehingga hal ini perlu diperhatikan pada RT-PCR kualitatif dalam penilaian MRD.
Kelainan sitogenetik hanya dapat dideteksi pada 50-60% kasus AML. Di antara pasien AML dengan kariotipe normal, skrining molekuler mampu mengidentifikasi mutasi gen pada 90% kasus. Tiga kategori berbeda yang dicirikan oleh mutasi gen somatik (klasifikasi WHO):
● AML dengan mutasi NPM1
Mutasi NPM1 terjadi pada 25-35% AML secara keseluruhan dan berhubungan dengan kariotipe normal, frekuensi ITD (internal tandem duplication) FLT3 yang tinggi, serta respons baik terhadap kemoterapi induksi. Tanpa adanya ITD FLT3, mutasi NPM1 umumnya berhubungan dengan hasil klinis baik dan memuaskan. Mutasi NPM1 biasanya terdiri dari insersi pada ekson 12 yang menyebabkan frameshift. Mutasi NPM1 dapat dideteksi dengan PCR capillary electrophoresis (PCR-CE) atau sekuensing Sanger. Teknik imunohistokimia (IHC) dapat disandingkan atau sebagai alternatif untuk mendeteksi ekspresi protein NPM1 di sitoplasma dikarenakan mutasi NPM1 menciptakan sinyal ekspor nukleus yang memediasi lokalisasi protein NPM1 dari nukleus ke sitoplasma.
● AML dengan mutasi CEBPA
Mutasi CEBPA terjadi pada 5-15% AML dan berperan dalam menghalangi diferensiasi myeloid. Mutasi terminal-N biasanya merupakan mutasi nonsense yang menyebabkan ekspresi CEBPA terputus, sedangkan mutasi terminal-C biasanya merupakan mutasi in-frame yang menghasilkan CEBPA mutan dengan penurunan kemampuan pengikatan DNA. Kedua mutasi paling sesuai dideteksi dengan sekuensing Sanger.
● AML dengan mutasi RUNX1
Mutasi somatik bi-allele pada RUNX1 terjadi pada 10-20% kasus AML. Mutasi RUNX1 mengganggu diferensiasi stem cell myeloid. Metode deteksi mutasi RUNX1 yang paling sesuai yaitu sekuensing Sanger.
Selain mutasi di atas, banyak mutasi somatik lainnya telah diidentifikasi pada AML yang memiliki signifikansi prognostik, seperti gen pada jalur transduksi sinyal berikut:
- Mutasi FLT3 adalah kelainan paling umum yang diketahui pada AML dengan kariotipe diploid. Ada dua jenis mutasi utama, yaitu ITD di wilayah juxtamembrane (20–30% AML) dan mutasi titik pada kodon 835 atau 836 di domain tirosin kinase (TKD) (5–10% AML). ITD FLT3 dapat dideteksi dengan PCR-CE atau sekuensing Sanger.
- Mutasi KRAS dan NRAS terjadi pada 5–10% AML secara keseluruhan, dan lebih sering terjadi pada AML dengan diferensiasi monositik (30–40%). Mutasi KRAS/NRAS hampir selalu terjadi pada kodon 12, 13, dan 61 yang mengarah pada aktivasi konstitutif jalur pensinyalan RAS/RAF/MAPK, dan mutasi tersebut paling baik dideteksi dengan pyrosequencing.
- Mutasi KIT lebih sering terlihat pada faktor pengikatan inti pada AML (20-30%); dan terutama terdiri dari mutasi missense pada ekson 17 (paling sering kodon 816) dalam domain kinase. Mutasi KIT memberikan fosforilasi KIT dan aktivasi konstitutif dari efektor downstream termasuk STAT3, MAPK, dan PI3K. Mutasi KIT (mutasi D816V) paling sesuai dideteksi dengan PCR spesifik mutasi.
- Gen yang terlibat dalam metilasi DNA (TET2, DNMT3A, IDH1, IDH2), modifikasi kromatin (ASXL1, EZH2), regulasi transkripsi (TP53), dan splicing RNA (SF3B1, SRSF2, U2AF1, ZRSR2) juga sering bermutasi di AML.
Metode yang direkomendasikan untuk pengujian molekuler pada AML yaitu skrining RT-PCR multipleks kuantitatif untuk penilaian translokasi/inversi berulang yang lebih penting, seperti t(8;21), inv(16)/t(16;16), t( 15;17), t(9;22). Setiap hasil RT-PCR positif harus diikuti dengan pemeriksaan RT-PCR kuantitatif real-time. Kasus dengan translokasi/inversi spesifik dapat dipantau paling baik dengan PCR kuantitatif real-time. Demikian pula, kasus dengan mutasi tunggal dapat diikuti dengan pengujian independen, sedangkan kasus dengan dua mutasi atau lebih dapat dibantu dengan NGS. NPM1 telah terbukti sebagai biomarker paling stabil untuk monitoring MRD, sedangkan ITD FLT3 tidak sesuai untuk monitoring MRD karena sifatnya kurang stabil dan masih menjadi perdebatan untuk MRD.
Chronic Myeloid Leukemia (CML)
CML adalah neoplasma mieloproliferatif yang ditentukan oleh kemunculan Philadelphia chromosome (Ph) yang dihasilkan dari fusi t(9;22) (q34;q11.2)/BCR-ABL1. Protein fusi BCR-ABL1 chimeric berperang penting dalam patogenesis CML dan terapi target TKI (tyrosine kinase inhibitors). Translokasi t(9;22) (q34;q11.2) dapat dideteksi dengan analisis kariotipe untuk ~95% kasus pada diagnosis awal. Pada kasus langka dengan translokasi samar/kriptik, dapat dideteksi dengan metode FISH dan/atau RT-PCR. Setelah berkembang ke fase akselerasi atau fase blast, sel-sel neoplastik biasanya memperoleh kelainan sitogenetik tambahan, yaitu paling sering trisomi 8, salinan kedua dari Ph, iso-kromosom 17q, trisomi 19, dan mutasi pada domain ABL1 kinase (menyebabkan resistensi terhadap TKI). Monitoring ketat pada tingkat transkripsi fusi BCR-ABL1 dan deteksi dini mutasi ABL1 sangat penting untuk intervensi terapeutik optimal. Meskipun analisis kariotipe kurang sensitif (sensitivitas 5%), teknik ini merupakan satu-satunya metode yang dapat mendeteksi kelainan sitogenetik tambahan (evolusi klonal). Direkomendasikan pada diagnosis awal, setiap 6 bulan hingga tercapainya CCyR (complete cytogenetic response) dan kemudian setahun sekali. Analisis FISH dan qRT-PCR juga direkomendasikan pada diagnosis awal.
Mutasi domain ABL1 kinase adalah mekanisme resistensi yang paling umum terhadap TKI dengan 40-90% kasus resistensi TKI. Lebih dari 50 mutasi titik ABL1 yang berbeda telah diidentifikasi, dan mutasi yang berbeda memiliki profil resistensi yang berbeda-beda terhadap TKI. Oleh karena itu, keberadaan dan jenis mutasi titik dapat mempengaruhi penentuan pengobatan.Mutasi ABL1 dapat dideteksi dengan sekuensing Sanger (sensitivitas 20%), pyrosequencing (sensitivitas 5%), PCR spesifik mutasi (sensitivitas 0,01–0,001%, setelah Sanger) dan NGS.
Neoplasma Mieloproliferatif (MPN)
MPN ditandai dengan proliferasi setidaknya satu garis keturunan hematopoietik dengan cacat maturasi minimal. Sebagian besar MPN berhubungan dengan kelainan molekuler melibatkan gen pengkode protein tirosin kinase yang mengaktifkan jalur pensinyalan JAK-STAT. Tiga mutasi utama dan saling eksklusif, yaitunya JAK2, CALR dan MPL, yang ketiganya disebut sebagai “driver mutation” karena perannya dalam mendorong fenotip MPN. “Triple negative” MPN (~10% kasus) mengacu pada pasien dengan MPN yang tidak memiliki salah satu dari tiga mutasi yang disebutkan sebelumnya.
- JAK2 V617F telah diidentifikasi pada 95–97% dari kasus PV (polycythemia vera) serta 50–60% ET (essential thrombocythemia) dan PMF (primary myelofibrosis). Allele burden yang tinggi pada JAK2 V617F terkait dengan peningkatan risiko fibrosis dan trombosis. Kasus 3–5% selebihnya dari PV dapat membawa mutasi pada JAK2 exon 12, atau yang lebih langka, SH2B3 dan CBL.
- Mutasi CALR terjadi pada sebagian besar kasus ET dan PMF dengan JAK2-negatif. Dua tipe umum mutasi frameshift CALR pada exon 9 antara lain, tipe 1 (delesi 52 bp) dan tipe 2 (insersi 5 bp). keduanya menghasilkan protein mutan yang kehilangan KDEL (ER-retention motif) di C-terminus.
- Mutasi missense pada kodon 515 gen MPL mewakili mutasi pendorong yang paling langka terjadi pada MPN, terjadi pada ~5% kasus ET dan PMF.
Jenis MPN lainnya dengan kelainan molekuler yakninya CNL (chronic neutrophilic leukemia) yang ditandai dengan neutrofilia absolut persisten. Sekitar 80-90% pasien CNL mengalami mutasi pada CSF3R. Sebagian besar kasus mengalami mutasi titik di daerah proksimal membran (paling umum T618 di exon 14) yang menginduksi aktivasi jalur JAK-STAT dan sensitif terhadap ruxolitinib. Sebaliknya, sebagian kecil pasien membawa mutasi frameshift atau mutasi nonsense pada exon 17 yang mengaktifkan jalur SRC dan sensitif terhadap dasatinib.
Skrining untuk transkrip fusi BCR-ABL1 dan tige driver mutation (JAK2, CALR, MPL) direkomendasikan sebagai pemeriksaan awal untuk semua dugaan MPN. Bergantung pada SOP klinis setiap instansi medis, metode diagnosis PV, ET dan PMF dapat ditentukan dengan pengujian berurutan JAK2 V617F dan pengujian berikut JAK2 exon 12 (dugaan PV atau CALR) dan MPL (dugaan ET dan PMF). Tindakan lanjutan kasus dengan driver mutation tunggal telah ditentukan, metode seperti pyrosequencing, qPCR spesifik mutasi dan ddPCR dapat digunakan untuk mendeteksi JAK2 V617F dan MPL W515L/K. Mutasi CALR dapat dideteksi dengan PCR-CE. Ruxolitinib telah terbukti bermanfaat dalam meningkatkan kelangsungan hidup pasien bila diterapkan pada kasus PMF. Namun, adanya penurunan allele burden JAK2 mutan mampu membatasi peran JAK2 V617F dalam monitoring MRD.
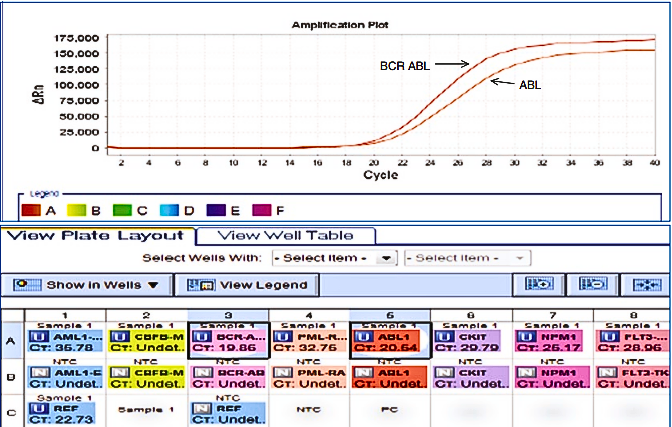
Gambar 1. Contoh AML positif BCR-ABL. Gambar menunjukkan lagi tata letak plate-well dan plot amplifikasi di AML (source: Bhargava, 2021. Springer).
Sindrom Myelodysplastic (MDS)
Sindrom mielodisplastik adalah kelompok kanker darah dengan sitopenia dan displasia morfologis setidaknya padu salah satu garis keturunan sel myeloid, eritroid atau megakariositik, yang menyebabkan hematopoiesis pada sumsum tulang tidak efektif dan meningkatkan risiko AML. Lebih dari 50 gen dengan mutasi somatik telah diidentifikasi pada MDS dan sekitar 90% pasien memiliki satu mutasi (2-3 mutasi per pasien). Mutasi paling umum pada gen splicing RNA (SF3B1, SRSF2, U2AF1, ZRSR2), metilasi DNA (TET2, DNMT3A, IDH1, IDH2) dan modifikasi kromatin (ASXL1, EZH2). Aberasi molekuler lainnya terjadi pada gen regulasi transkripsi (RUNX1, TP53), transduksi sinyal (FLT3, NRAS, KRAS) dan kompleks kohesin (STAG2, RAD21).
Pengujian molekuler terekomendasi pada diagnosis awal MDS adalah NGS dengan panel mencakup setidaknya semua gen di atas. Apabila kasus mutasi tunggal diketahui, metode pyrosequencing, PCR untuk mutasi “hotspot”, atau sekuensing Sanger untuk gen tanpa mutasi “hotspot”. Sekuensing Sanger mungkin tidak cocok digunakan untuk monitoring MRD dikarenakan sensitivitas rendah. Kasus dengan dua mutasi atau lebih dapat diikuti dengan metode NGS apabila memungkinkan.
Myelodysplastic/Myeloproliferative Neoplasms
Myelodysplastic/myeloproliferative neoplasms dicirikan dengan MDS dan MPN, yang terdiri dari jenis-jenis berikut:
- chronic myelomonocytic leukemia (CMML)
- chronic myelomonocytic leukemia (CMML)
- juvenile myelomonocytic leukemia (JMML)
- MDS/MPN dengan ring sideroblasts
- thrombocytosis (MDS/MPN-RS-T) MDS/MPN
- unclassifiable (MDS/MPN-U) MDS/MPN
Profil mutan setiap jenis bersifat unik, dan direkomendasikan untuk menggunakan panel NGS bertarget umum untuk deteksi molekuler guna evaluasi awal dan/atau monitoring selanjutnya.
Neoplasma Limfoid
Neoplasma limfoid terdiri dari leukemia limfoid, limfoma limfoid, dan mieloma, yang dihasilkan oleh proliferasi dan ekspansi klon limfosit B dan T pada berbagai tahap diferensiasi. Diagnosis, prognosis dan stratifikasi pasien dapat dilakukan dengan evaluasi morfologi, immunophenotyping, profil sitogenetik, deteksi mutasi gen, dan analisis klonalitas.
Sebagian besar neoplasma limfoid agresif dan lamban berasal dari sel B, meliputi acute lymphoblastic leukemia/lymphoma dan mature B-cell leukemias/lymphoma. Berdasarkan imunofenotip spesifik pada tahap diferensiasi sel B, tumor ini biasanya dapat didiagnosis dan diklasifikasikan. Tumor ganas/malignan sel T matur mempunyai patogenesis dan perilaku klinis lebih kompleks serta umumnya subset neoplasma sel T berhubungan dengan infeksi virus tertentu, misalnya HTLV-1 (human T-cell leukemia virus) pada leukemia/limfoma sel T dewasa dan EBV (Epstein–Barr virus) pada leukemia sel NK .
Pengujian klonalitas sel B dan sel T adalah kategori pengujian molekuler yang paling umum pada malignansi limfoid. Proses rekombinasi pada sel B dan sel T merupakan dasar molekuler untuk deteksi klon, termasuk V (variable), D (diversity), dan J (joining) segmen DNA pada gen IGH (immunoglobulin heavy chain) dan gen TCR (T-cell receptor), masing-masing memberikan basis molekuler untuk pengujian klonalitas. Metode PCR paling umum digunakan mengevaluasi rearrangement gen IGH [tumor sel B] ataupun rearrangement TCRB (T-cell receptor beta) dan TCRG (T-cell receptor gamma) [tumor sel T].
Leukemia Limfoid
- Acute lymphoblastic leukemia (ALL)
ALL merupakan jenis yang paling sering terjadi pada anak-anak. Sel tumor dapat berasal dari prekursor sel B atau sel T, meskipun sebagian besar berasal dari garis keturunan sel B. Studi rearrangement gen IGH dan TCR digunakan sebagai marker klonalitas dan deteksi MRD. Kelainan kromosom terdeteksi pada sekitar 80% kasus ALL. Adanya t(12;21)(p13.2;q22.1) merupakan bukti menjadi lesi genetik paling umum pada ALL anak-anak, yang menggabungkan gen ETV6 (pada 12p13.2) dengan gen RUNX1/AML1 (pada 21q22.1).Translokasi resiprokal yang biasa terlihat di ALL termasuk t(8;14)(q24.2;q32.3), t(4;11) (q21.3;q23.3), t(1;19), dan t(9;22)(q34.1;q11.2). Kelainan kromosom seperti ini dapat dideteksi dengan kombinasi metode FISH dan PCR. Mutasi gen yang sering terdeteksi pada B/T-ALL antara lain FBXWl, JAK2, KRAS, NOTCH1, NRAS dan TP53. Kariotipe konvensional juga dapat mendeteksi hiperdiploidi atau hipodiploidi pada kasus ALL. - Chronic lymphocytic leukemia (CLL)
CLL adalah bentuk leukemia paling umum pada orang dewasa. CLL dan SLL (small lymphocytic lymphoma) muncul sebagai proses penyakit low-grade dan lamban (indolen). Marker limfositosis perifer adalah limfosit kecil CD5+, CD20+, CD23+. Limfosit tersebut muncul dari sel B monoklonal dan ditandai dengan kurangnya translokasi kromosom resiprokal.Namun jenis kelainan kromosom lainnya masih rutin terdeteksi pada pasien CLL, yaitu delesi 11q23, 13q14 (melibatkan microRNA-15a dan microRNA-16), 17p13.3 (gen supresor tumor TP53), dan trisomi 12. Teknik standar deteksi pengobatan pada kelainan ini dapat menggunakan menggunakan FISH atau aCGH. Gen yang biasa ditemukan bermutasi pada CLL adalah ATM, BIRC3, BTK, NOTCH1, XPO1, PLCG2, SF3B1, TP53.
Lymphoma (Limfoma)
Limfoma adalah kelompok besar penggolongan kanker darah limfosit B dan T. Setiap tahun, hampir setengah kasus kanker darah adalah limfoma. Immunophenotyping berperan utama dalam diagnosis penyakit ini. Marker molekuler yang umum adalah translokasi kromosom spesifik. Translokasi kromosom tersebut mengeksploitasi elemen regulasi transkripsi gen imunoglobulin (Ig) (promotor dan enhancer) untuk mendorong ekspresi onkogen dalam sel B ganas atau prekursor sel B. Misalnya, elemen transkripsi IGH pada kromosom 14 digunakan dalam t(14;18) pada limfoma folikuler untuk mendorong ekspresi BCL-2, serta elemen tersebut digunakan dalam limfoma Burkitt untuk mengekspresikan c-MYC secara berlebihan dengan translokasi t(8;14).
Tabel 1. Deteksi translokasi terkait limfoma yang melibatkan peningkat gen imunoglobulin.
| Translokasi | Gen | PCR | Metode Alternatif |
| t(14;18) (q32;q21) | BCL2 | Primer breakpoint MBR (follicular lymphoma breakpoint region) mendeteksi 60-70% kasus | Dual-fusion FISH G-banded karyotype |
| t(11;14) (q13;q32) | CCNDI | Primer breakpoint MTC (major translocation cluster) mendeteksi 30-35% kasus | Dual-fusion FISH G-banded karyotype |
| t(8;14) (q24;q32) t(2;8) (p12;q24) t(8;22) (q24;q11) | MYC | Tidak ada, mengingat besarnya area breakpoint di MYC | Pisahkan FISH untuk mendeteksi partner MYC |
| t(3;14) (q27;q32) | BCL6 | Tidak ada, mengingat area breakpoint berukuran besar di BCL6 | Pisahkan FISH untuk mendeteksi partner BCL6 |
Myeloma
Myeloma sel plasma adalah penyakit kompleks secara genetik yang muncul dari ekspansi sel plasma klonal dan paling sering terjadi di sumsum tulang. Studi molekuler telah mengungkapkan bahwa heterogenitas intraklonal adalah gambaran umum pada myeloma sel plasma. Peristiwa genetik utama yang berkontribusi terhadap imortalisasi sel plasma dapat dibagi menjadi dua kelompok:
- kelompok hiperdiploid, ditandai dengan trisomi kromosom bernomor ganjil,
- kelompok non-hiperdiploid, ditandai dengan translokasi IGH ke berbagai kromosom pasangan
Peristiwa genetik sekunder berkontribusi kompleks terhadap perkembangan penyakit myeloma dengan keterlibatan translokasi sekunder, CNV (copy number variants), akuisisi mutasi, LOH (loss of heterozygosity), dan modifikasi epigenetik. Mutasi signifikan yang ditemukan pada myloma antara lain BRAF, FGFR3, KRAS, TP53, dan FGFR3.
Tabel 2. Panel investigasi molekuler kanker darah dengan metode PCR.
| Panel | Deskripsi |
| Kualitatif
BCR-ABL |
Major, Minor, Micro |
| BCR-ABL (IS, International Scale) | Major, Minor, Micro |
| Mutasi JAK2 | V617F |
| Panel Mutasi MPN | BCR-ABL1, JAK2, CALR dan MPL |
| Panel Komprehensif AML | BCR-ABL1, PML-RaRa, AML ETO gene (RUNX1;RUNX1T1), Inv16, FLT3 (ITD/TKD), NPM1, c-KIT, CEBPA |
| Panel Komprehensif ALL | BCR-ABL1, ETV6-RUNX1(TEL-AML1), MLL-AF4 t(4;11), MLL-AF9 t(9;11), MLL-ENL t(11;1 19), TCF3-PBX1 (E2A-PBX1) |
Molekuler Hemato-Onkologi geneMAP™ RT-qPCR Kits
Kit Onkologi Molekuler geneMAP™ (GenMark, Turki) menawarkan rangkaian produk kit berstandar CE-IVD yang inovatif dalam manajemen malignansi hematologi dan kanker darah. Keragaman dan kelengkapan pengujian kuantitatif, multipleks, akurat, tepat dan biaya terjangkau mampu meningkatkan kualitas dan proses klinis dalam diagnosis dan tindakan lanjut pengobatan.
Tabel 3. Hemato-Onkologi geneMAP™ PCR kits multipleks dan kuantitatif.
| Katalog | Deskripsi | Grade |
| BCR210-RT48 | geneMAP™ BCR-ABL1 p210(Mbcr) IS-MMR Detection Kit, 48T | CE-IVD |
| BCR190-RT48 | geneMAP™ BCR-ABL1 p190(mbcr) Detection Kit, 48T | CE-IVD |
| BCR230-RT48 | geneMAP™ BCR-ABL1 p230(ubcr) Detection Kit, 48T | CE-IVD |
| BCRSCR-RT48 | geneMAP™ BCR-ABL1 (p190, p210, p230) Screening Kit, 48T | CE-IVD |
| AML1-RT24 | geneMAP™ RUNX1-RUNX1T1 t(8;21) Detection Kit, 24T | CE-IVD |
| E2A-RT24 | geneMAP™ TCF3/PBX1 t(1;19) Detection Kit, 24T | CE-IVD |
| MLL-RT24 | geneMAP™ MLL-AF4 t(4;11) Detection Kit, 24T | CE-IVD |
| TEL-RT24 | geneMAP™ TEL-AML1 t(12;21) Detection Kit, 24T | CE-IVD |
| CBF-RT24 | geneMAP™ CBFB-MYH11 Inv(16) Detection Kit, 24T | CE-IVD |
| PML-RT24 | geneMAP™ PML-RARA t(15;17) bcr1&bcr2, bcr3 Detection Kit, 24T | CE-IVD |
| MPL-RT25 | geneMAP™ MPL W515A/L/K/R Mutation Detection Kit, 25T | CE-IVD |
| SMT-RT50 | geneMAP™ Somatic Mutation(JAK2 V617F) Detection Kit, 50T | RUO |
| JK12Q-RT50 | geneMAP™ JAK2 Exon 12 Mutations Detection Kit, 50T | CE-IVD |
| FLT3-RT25 | geneMAP™ FLT3 D835Y Mutation Detection Kit, 25T | CE-IVD |
| *FLT3-FA25 | geneMAP™ FLT3 ITD/D835Y Mutation Detection Kit, 25T | CE-IVD |
| NPMQ-RT24 | geneMAP™ NPM1 (MutA,B,C&D) Mutation Detection Kit, 24T | CE-IVD |
| CALR-RT25 | geneMAP™ CALR Mutation Screening Kit, 25T | RUO |
| FIP1-RT24 | geneMAP™ FIP1L1-PDGFRA Detection Kit, 24T | CE-IVD |
| cKIT-RT25 | geneMAP™ c-KIT D816V Mutation Detection Kit, 25T | CE-IVD |
| WT1-RT24 | geneMAP™ WT1 Expression Analysis Kit,24 T | CE-IVD |
| IDH-RT25 | geneMAPTM IDH1/225T Mutations Detection Kit | RUO |
Referensi:
- Sinchita Roy-Chowdhuri, Paul A. VanderLaan, John M. Stewart, Gilda da Cunha Santos. 2018. Molecular Diagnostics in Cytopathology: A Practical Handbook for the Practicing Pathologist. Springer.
- Mohammad A. Vasef, Aaron Auerbach. 2019. Diagnostic Pathology: Molecular Oncology. Elsevier.
- William B. Coleman, Gregory J. Tsongalis. 2016. Diagnostic Molecular Pathology: A Guide to Applied Molecular Testing. Academic Press.
- Manorama Bhargava. 2021. Hematologic Malignancies. Case Studies in Cytogenetic and Molecular Genetics. Springer.
- Shiyang Pan, Jinhai Tang. 2021. Clinical Molecular Diagnostics. Springer.