Introduksi Teknik Imunofluoresensi dengan Immunofluorescence Kit
A. Teknik Imunofluoresensi
Imunofluoresensi (IF) dapat memberikan informasi mengenai lokalisasi seluler dan subseluler dari protein teknik berdasarkan teknik imunohistokimia (IHC) [Lihat Teknik IHC]. Teknik IF memungkinkan visualisasi protein berdasarkan pengikatan antibodi ke protein target diikuti dengan visualisasi antibodi dengan mengkonjugasikan antibodi ke enzim yang mengkatalisis reaksi penghasil warna atau dengan mengkonjugasikan antibodi ke fluorofor. Teknik ini dapat digunakan untuk memvisualisasikan protein dalam sel (suspensi atau adheren), jaringan dan spheroid dari kultur 3D.
Teknik IF dapat menunjukkan ko-lokalisasi protein saat imunohistokimia (IHC) tidak bisa. Pencitraan IF tergantung pada emisi cahaya dari antibodi terkonjugasi fluorofor. Fluorofor adalah senyawa kimia fluoresen yang dapat menyerap cahaya pada panjang gelombang tertentu akan menghasilkan emisi cahaya pada panjang gelombang energi yang lebih panjang atau lebih rendah. Contohnya, Alexa-488 memiliki puncak eksitasi 495 nm dan memancarkan cahaya dengan puncak emisi pada 519nm (spektrum hijau), sedangkan Alexa-594 lainnya memiliki puncak eksitasi 590 nm dan puncak emisi pada 617 nm (spektrum merah).
Karena berbagai jenis fluorofor memiliki panjang gelombang eksitasi dan emisi yang berbeda, banyak antigen dapat divisualisasikan pada sampel biologis yang sama dengan mengkonjugasikan beberapa antibodi pendeteksi antigen ke fluorofor yang berbeda. Keunggulan lainnya dari IF adalah kemampuan untuk menangkap gambar pada mikroskop confocal untuk menentukan lokalisasi seluler dari protein yang diinginkan. Mikroskopi konfokal meningkatkan resolusi optik dengan menyaring cahaya yang dipancarkan dari bidang yang tidak fokus. Perangkat lunak pencitraan confocal juga memungkinkan pengambilan gambar pada beberapa bidang fokus yang memungkinkan pencitraan 3D dari spesimen. Aplikasi ini sangat berguna dalam mempelajari struktur berbagai organ seperti kelenjar susu dan pembuluh darah. Penting untuk diketahui bahwa pewarnaan IF sangat sensitif terhadap photobleaching dan oleh karena itu slide yang diwarnai dapat dipertahankan dalam freezer −20°C untuk waktu yang terbatas. Berbeda dengan pewarnaan IHC tradisional yang dapat dipertahankan untuk waktu yang lama.
B. Prinsip Kerja
Protokol IF diklasifikasikan menjadi dua kelompok tergantung pada apakah menggunakan satu antibodi atau dua antibodi (primer dan sekunder) untuk pelabelan fluorofor dari antigen yang diinginkan. Kedua metode memiliki kelebihan dan kekurangan, sehingga harus dipertimbangkan sebelum memulai IF.
1) Imunofluoresensi Langsung
Protokol IF langsung yakninya hanya melibatkan antibodi terkonjugasi fluorofor ke antigen target. Kelebihan dari metode langsung ini antara lain protokol sederhana untuk pelabelan beberapa antigen, waktu inkubasi lebih singkat dan pewarnaan dengan banyak antibodi yang dihasilkan pada spesies yang sama tidak menimbulkan masalah. Kekurangan metode ini yaitu tidak ada amplifikasi sinyal sehingga intensitas pewarnaan rendah jika antigen tidak banyak serta keterbatasan ketersediaan dan biaya antibodi terkonjugasi fluorofor. Metode pelabelan kekebalan ini umumnya digunakan untuk aplikasi flow-cytometry [Lihat Teknik Flow Cytometry].
2) Imunofluoresensi Tidak Langsung
Teknik ini menggunakan metode deteksi antigen oleh antibodi sekunder terkonjugasi fluorofor yang mengenali antibodi primer tidak berlabel yang terikat pada antigen yang diinginkan diklasifikasikan sebagai IF tidak langsung. Beberapa antibodi sekunder dapat terikat pada antibodi primer, sehingga amplifikasi sinyal dihasilkan yang sangat berguna untuk mendeteksi antigen yang jarang atau tidak terlalu banyak.
Kelebihan metode tidak langsung yaitu antibodi sekunder dapat mengenali semua antibodi primer yang berasal dari spesies host, protokol ini lebih fleksibel dan hemat biaya. Namun, jika melakukan pelabelan beberapa antigen, antibodi-antibodi primer harus berasal dari spesies yang berbeda untuk mencegah reaktivitas silang. Selain itu, sampel dengan ekspresi imunoglobulin endogen yang tinggi dapat menghasilkan background tinggi yang akan mengganggu pencitraan fluoresensi.
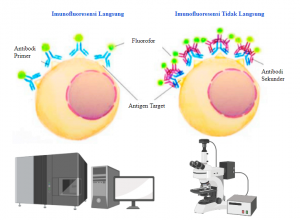
Gambar 1. Imunofluoresensi Langsung dan Tidak Langsung.
C. Aplikasi Imunofluoresensi
Teknik IF sering digunakan untuk patologi klinis dan penelitian. Penelitian menggunakan IF ditujukkan untuk menentukan ekspresi gen spesifik organ, spesifik jaringan, atau spesifik sel dari antigen terkait intraseluler dan membran sel. Selain sel eukariotik, teknik IF juga dapat digunakan untuk mengidentifikasi keberadaan bakteri, virus, atau parasit lain dalam sampel. Teknik IF juga biasanya digunakan untuk diagnosis kelainan dermatologis seperti gangguan bulosa dan jaringan ikat, vaskulitis, serta kondisi seperti lichen planus dan dermatosis bersisik (terutama psoriasis). Diagnosis penyakit pernapasan akibat infeksi virus dapat didiagnosis dengan tes berbasis IF langsung.
D. Keterbatasan Umum Imunofluoresensi
Seperti halnya berbagai teknik biokimia, teknik IF dan hasil juga memiliki berbagai keterbatasan. Keterbatasan utama IF sebagai berikut:
1) Photobleaching
Pencitraan IF membutuhkan eksitasi fluorofor pada panjang gelombang tertentu yang menghasilkan emisi cahaya yang dapat dideteksi oleh mikroskop fluoresensi. Proses ini juga menghasilkan pembentukan ROS yang dapat berinteraksi dengan fluorofor sehingga mencegah eksitasi optimal fluorofor seiring berjalannya waktu. Photobleaching dapat dicegah dengan mengoptimalkan waktu pemaparan ke panjang gelombang eksitasi, menggunakan agen scavenger ROS, atau menggunakan fluorofor khusus untuk meminimalkan photobleaching.
2) Autofluoresensi
Pencitraan IF berkualitas tinggi sangat bergantung pada perolehan antibodi afinitas tinggi yang sangat spesifik terhadap target. Sampel biologis dapat menunjukkan autofluoresensi karena adanya NADH (absorpsi 340 nm, emisi 460 nm) dan FAD-FMN (absorpsi 450 nm dan emisi 460 nm) yang berperan penting dalam pengaturan metabolisme sel. Dengan demikian, deteksi fluorofor yang memancarkan cahaya dalam spektrum hijau dapat menghasilkan rasio signal-to-noise yang rendah.
Seringkali masalah dengan autofluoresensi dapat dihilangkan dengan menggunakan antibodi afinitas tinggi yang lebih spesifik atau dengan mengoptimalkan proses fiksasi. Metode fiksasi menggunakan aldehid seperti glutaraldehid dapat menghasilkan autofluoresensi tinggi yang dapat dilemahkan dengan mencuci dengan 0,1% natrium borohidrida dalam PBS sebelum inkubasi antibodi. Pemilihan probe dan filter optik yang tepat dapat meminimalkan masalah dengan autofluoresensi. Sebagai alternatif, untuk protein yang tidak dapat dengan mudah, versi protein terkonjugasi fluoresen dari protein seperti GFP dapat dihasilkan untuk menjawab pertanyaan penelitian.
3) Overlapping (Tumpang Tindih) Fluorofor
Overlapping fluorofor adalah masalah umum saat melakukan pencitraan untuk beberapa target dalam sampel yang sama. Masalah muncul ketika dua atau lebih fluorofor yang digunakan memancarkan cahaya pada panjang gelombang yang sama. Untuk mendapatkan pencitraan IF, eksitasi klorofil oleh sumber cahaya menghasilkan emisi cahaya dari fluorofor pada rentang panjang gelombang yang sempit. Sebagai contoh, Alexa-430 memiliki eksitasi 434 nm dan emisi 539nm, sedangkan Alexa-514 memiliki eksitasi 518 nm dan 540 nm. Jika dua fluorofor digunakan untuk melabeli antigen yang berbeda, mikroskop fluoresensi tidak akan dapat membedakan antara cahaya yang dipancarkan dari dua fluorofor karena tumpang tindih (overlap) yang signifikan antara spektrum emisinya. Solusi yang dapat dilakukan yaitu apabila menggunakan Alexa-434, maka direkomendasikan untuk menggunakan Alexa-594 (eksitasi 590 nm dan emisi 617 nm), sehingga spektrum emisi dari dua fluorofor tidak akan tumpang tindih dan dapat dibedakan secara optimal.
Tabel 1. Immunofluorescence kit untuk antibodi primer berasal dari rabbit dan mouse
| Brand | Katalog | Deskripsi Produk | Ukuran |
| Elabscience | E-IR-R321 | Immunol Fluorescence Staining Kit (Anti-Rabbit IgG-Cy3) | 50T, 100T, 200T |
| Elabscience | E-IR-R323 | Immunol Fluorescence Staining Kit (Anti-Rabbit IgG-FITC) | 50T, 100T, 200T |
| Elabscience | E-IR-R325 | Immunol Fluorescence Staining Kit (Anti-Rabbit IgG-AF488) | 50T, 100T, 200T |
| Elabscience | E-IR-R327 | Immunol Fluorescence Staining Kit (Anti-Rabbit IgG-AF594) | 50T, 100T, 200T |
| Elabscience | E-IR-R322 | Immunol Fluorescence Staining Kit (Anti-Mouse IgG-Cy3) | 50T, 100T, 200T |
| Elabscience | E-IR-R324 | Immunol Fluorescence Staining Kit (Anti-Mouse IgG-FITC) | 50T, 100T, 200T |
| Elabscience | E-IR-R326 | Immunol Fluorescence Staining Kit (Anti-Mouse IgG-AF488) | 50T, 100T, 200T |
| Elabscience | E-IR-R328 | Immunol Fluorescence Staining Kit (Anti-Mouse IgG-AF594) | 50T, 100T, 200T |
Tabel 2. Kebutuhan teknik Flow Cytometry
[Lihat reagent Flow Cytometry]
E. Referensi
1. Betterle C, Zanchetta R. 2012. The immunofluorescence techniques in the diagnosis of endocrine autoimmune diseases. Autoimmune Highlights. 3(2):67-78.
2. Fincham REA, Bashiri H, Lau MC, Yeong J. 2022. Editorial: Multiplex Immunohistochemistry/Immunofluorescence Technique: The Potential and Promise for Clinical Application. Front Mol Biosci. 9:831383.
3. Jalali M, Saldanha FYL, Jalali M. 2017. Basic Science Methods for Clinical Researchers. Academic Press.
4. Shojaeian S, Maslehat Lay N and Zarnani A-H. 2020). Detection Systems in Immunohistochemistry. Immunohistochemistry – The Ageless Biotechnology. IntechOpen.
F. Artikel Terkait
1. Introduksi Flow Cytometer dan Prinsip Kerjanya [Link]
2. Bagaimana Memilih Antibodi untuk Flow Cytometry [Link]
3. Aplikasi Metode Flow Cytometry dan Perkembangan Jenis Assay [Link]
4. Prosedur Flow Cytometry dan Seleksi Jenis Antibodi Flow Cytometry [Link]
5. IHC 1: Ready-to-Use Antibodies untuk IHC merk Elabscience® [Link]
6. IHC 2 : Panduan Imunohistokimia (IHK) untuk Preparat Paraffin [Link]
7. Memilih Antibodi Primer atau Sekunder [Link]
8. 6 Alasan Memilih Kit Deteksi Apoptosis Annexin V Merk Elabscience® [Link]
9. 5 Alasan Memilih Kit TUNEL Assay Merk Elabscience® [Link]

