Isolasi dan Identifikasi Sel T Helper Perifer (Tph) dengan Flowcytometry
Bagaimana cara mengisolasi dan mengidentifikasi sel T helper perifer (Tph) dengan metode flowcytometry dengan mengandalkan prosedur terstandar dan bahan material yang terekomendasi secara ilmiah dari kami.
A. Apa fungsi sel T helper?
Sel T helper (Tph) memiliki peran sangat penting dalam respons imunitas sel B dan produksi antibodi. Pada jaringan perifer, sel ini membantu mengakumulasi sel B, mengaktifkan sel B dan membantu produksi antibodi yang mengalami inflamasi kronis. Layaknya sel T helper folikular (Tfh) yang juga berperan penting dalam imunitas, sel Tph dapat dibedakan dari sel tersebut dalam segi fenotip, kapasitas migrasi dan regulasi transkripsi. Saat ini, sel Tph telah diamati dikaji pada beberapa penyakit imun, khususnya penyakit autoantibodi termasuk lupus, diabetes tipe 1, penyakit celiac, hepatitis autoimun, penolakan allograft, HIV dan beberapa tumor.
Sebelum mengidentifikasi sel Tph, perlu dipertimbagkan empat aspek dan karakteristik khusus sebagai parameter identifikasi sel tersebut:
a. Marker permukaan
Sel Tph mengekspresikan kadar PD-1 yang tinggi sekaligus mengekspresikan ICOS dan HLA-DR. Sel Tph juga mengekspresikan satu set reseptor kemokin yang berbeda, misalnya CCR2, CX3CR1, dan CCR5, yang memicu migrasi ke jaringan perifer.
b. Produksi sitokin
Sel ini menghasilkan IL-21 dan CXCR5 ligan CXCL13 (CXCL13-CXCR5). IL-21 berperan dalam menginduksi diferensiasi sel B menjadi sel plasma. Produksi CXCL13 berkontribusi dalam perekrutan sel B CXCR5+ dan menginduksi pembentukan organ limfoid ektopik di jaringan perifer sehingga sel Tph dapat bermigrasi.
c. Faktor transkripsi
Sel Tph mengekspresikan kadar PRDM1 tinggi yang merupakan counter-regulator BCL6 yang diekspresikan oleh sel Tfh. Baik sel Tph dan Tfh mengekspresikan faktor transkripsi MAF dalam kadar tinggi yang diperlukan untuk memproduksi IL-21 oleh sel T dan untuk menginduksi respons sel plasmablast secara in vitro oleh sel Tph.
d. Fungsi sel B helper
Sel Tph merangsang sel B untuk memperoleh sel plasmablast atau fenotip sel plasma secara in vitro.
B. Identifikasi sel T helper dari sirkulasi darah perifer
Sel Tph dapat diidentifikasi dengan metode flowcytometry multicolor dan mass cytometry. Pada flow cytometry, antibodi dikonjugasikan dengan fluorokrom yang memungkinkan deteksi melalui pendaran untuk beberapa marker sekaligus pada satu sel. Berikut kami menyediakan metode terperinci untuk mendeteksi sel Tph menggunakan flow cytometry, mulai dari mengisolasi sel hingga interogasi fungsional serta menyediakan informasi bahan dan kit referensi yang dapat digunakan.
I. Bahan
a) Sel-sel
Sampel yang digunakan dapat berasal dari sel mononuklear darah perifer (PBMC) atau sel yang diproses dari jaringan. Sampel diperoleh dengan menggunakan protokol laboratorium masing-masing. Sebelum hari percobaan, PBMC atau sel-sel dapat dikriopreservasi terlebih dahulu.
1) Isolasi sel mononuklear darah perifer (PBMC)
- Berikut kami menyediakan prosedur isolasi PBMC menggunakan regent buffer dari StemCell Technology. Isolasi sel mononuklear disarankan menggunakan media dengan densitas 1,077 g/mL, misalnya Lymphoprep™ (#07801 StemCell). Selain itu juga dibutuhkan media kultur buffer PBS + 2% FBS (#07905 StemCell) dan tabung sentrifugasi untuk selanjutnya melakukan sentrifugasi gradien densitas [protokol dan video].
b) Isolasi atau kultur sel
- Media lengkap: RPMI (#PM150110 Elabscience), 1% Penisilin/Streptomisin (#PB180120 Elabscience), 10% Fetal Bovine Serum (#FB-1001 Biosera), 1% Glutamin (#PB180420 Elabscience), 1% HEPES (#PB180325 Elabscience).
- Buffer MACS: 1× PBS tanpa Ca+/Mg+ (#PB180532 Elabscience); 10% FBS (#FB-1001 Biosera), 2 mM EDTA (#PB180320 Elabscience).
- Alternatif buffer MACS: EasySep™ Buffer (#20144 StemCell)
- EasySep™ Human CD4+ T Cell Isolation Kit (#17952 StemCell).
- Dynabeads Human T-Activator CD3/CD28 (Gibco)
- Brefeldin A (#ab120299, #ab193369 Abcam)
- Staphylococcal enterotoxin B (SEB)
c) Pewarnaan untuk Flowcytometry
- Buffer FACS: PBS (#PB180327 Elabscience) dengan 1% BSA (#E-IR-R108 Elabscience).
- Buffer fiksasi: PBS (#PB180327 Elabscience), 1% BSA (#E-IR-R108 Elabscience), 2% formaldehida.
- Buffer sorting FACS: PBS (#PB180327 Elabscience), 5% FBS(#FB-1001 Biosera), 2,5% 1 M HEPES (#PB180325 Elabscience).
- Antibodi monoklonal untuk flow cytometry.
- Foxp3/Transcription Factor Staining Kit (#E-CK-A108 Elabscience).
d) Alat platform dan Instrumentasi
- Flow cytometer.
- Flow sorter.
- 37°C water incubator atau water bath.
- EasySep™ Magnet for Cell Separation (#18000 StemCell).
II. Metode
a) Thawing Sel
- Siapkan tabung konikal 50 mL dan tambahkan 7 mL FBS (Lihat Catatan 1). Thawing sel kriopreservasi dengan menginkubasi tabung dalam water incubator 37°C selama 60 detik. Pindahkan sel ke dalam tabung konikal 50 mL. Cuci sel dengan media lengkap dan kemudian sentrifugasi pada 1500 rpm (483×g) selama 5 menit pada suhu ruang. Hitung sel dengan media lengkap. Staining sel disarankan untuk dilakukan dengan kisaran jumlah sel antara 0,1-1 juta sel. Cuci sel dengan media lengkap dan sentrifugasi pada 1500 rpm (483×g) selama 5 menit.
Catatan 1: Metode ini digunakan apabila lebih dari satu vial harus di-thawing. Untuk mencairkan satu vial, cukup tambahkan 1 mL FBS ke dalam tabung konikal 15 mL. Pindahkan sel setelah selesai thawing.
Tabel 1. Panel antibodi flowcytometry multicolor untuk identifikasi sel Tph.
| Antibodi | Klon | Fluorokrom | Brand | Ukuran |
| Live/dead | – | PI | #E-CK-A165 Elabscience | 100T |
| CD3 | UCHT1 | Elab Fluor® Red 780 | #E-AB-F1230S Elabscience | 100T |
| CD4 | RPA-T4 | PE/Cy7 | #E-AB-F1109H Elabscience | 100T |
| CD45RA | HI100 | APC-Cy7 | #100-0317 StemCell | 100T |
| PD-1 | EH12.2H7 | PE | #E-AB-F1229D Elabscience | 100T |
| CXCR5 | J252D4 | Brilliant Violet 421 | #356920 Biolegend | 100T |
| BCL6 | 7D1 | APC | #358506 Biolegend | 100T |
| CX3CR1 | 2A9-1 | FITC | #341606 Biolegend | 100T |
| CCR2 | K036C2 | APC | #357208 Biolegend | 100T |
| CXCL13 | 53,61 | Alexa Fluor® 700 | #IC8012N-100UG R&D | 100 µg |
| IL-2 | MQ1-17H12 | FITC | E-AB-F1200C Elabscience | 100T |
b) Identifikasi Sel Tph Menggunakan Flowcytometry
1) Protokol Staining
- Pindahkan sel ke dalam 1,5 mL FACS tabung staining polistiren (Lihat Catatan 2). Cuci sel dengan PBS dan sentrifugasi pada 1500 rpm (483×g) selama 5 menit.
- Inkubasi sampel selama 20 menit pada suhu 4°C dengan Live/dead PI dalam 100 μL PBS.
- Cuci sel dengan buffer FACS dan sentrifugasi pada 1500 rpm (483×g) selama 5 menit.
- Inkubasi sampel dengan antibodi (Tabel 1) selama 30–45 menit pada suhu 4°C. Campurkan secara merata.
- Ulangi langkah 3.
- Untuk staining intranuklear, fiksasi sampel menggunakan Foxp3/Transcription Factor Staining Kit (#E-CK-A108 Elabscience) dengan inkubasi sel dalam 500 μL buffer fiksasi/permeabilisasi Foxp3 (rasio konsentrat-diluen yakninya 1:3) selama 30 menit pada suhu 4°C. (Lihat Catatan 3).
- Cuci sel dengan buffer permeabilisasi dan sentrifugasi pada 1500 rpm (483×g) selama 5 menit.
- Staining sampel dengan marker faktor transkripsi pada buffer permeabilisasi selama 1 jam pada suhu ruang.
- Ulangi langkah 6 dan 3. Sebagai contoh strategi gating berdasarkan panel ini diilustrasikan pada Gambar 1.
Catatan 2: Metode ini menggunakan tabung untuk melakukan staining. Staining juga dapat dilakukan pada 96-well plate; Namun, langkah mencuci harus dilakukan sebanyak 2 kali, bukan sekali seperti yang direkomendasikan dengan penggunaan tabung.
Catatan 3: Penggunaan Foxp3/Transcription Factor Staining Kit (#E-CK-A108 Elabscience) dapat menggunakan protokol yang tertera pada kit
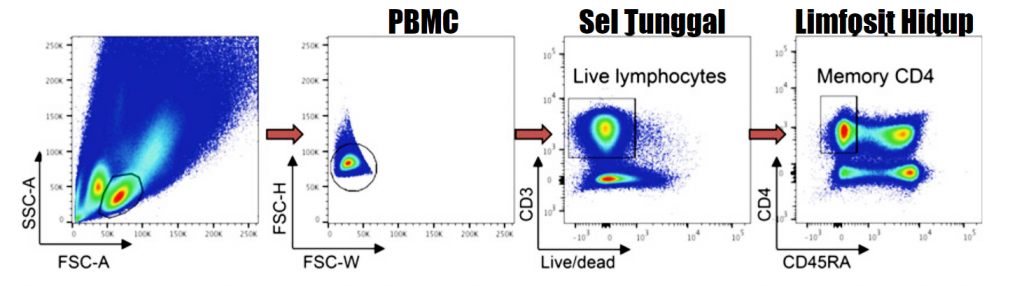
Gambar 1. Sel mononuklear kriopreservasi di-thawing dan di-staining dengan cocktail antibodi untuk strategi gating memilih sel T CD4+ memori singlet hidup dari PBMC.
2) Strategi Gating
- Gating populasi utama sel berdasarkan ukuran dan granularitas menggunakan FSC (forward scatter) dan SCC (side scatter), mengeluarkan debris-debris dan doublet potensial (Gambar 1) (Lihat Catatan 3).
- Gating sel-sel tunggal berdasarkan sifat lebar dan tinggi dari FSC atau SSC (FSC-W, FSC-H atau SSC-W, SSC-H) untuk mengeluarkan doublet (Lihat Catatan 4).
- Gating pada sel T CD3+ hidup (CD3+ Live/dead PI–).
- Gating pada sel T memori CD4+ mengekspresikan marker CD4 permukaan tanpa antigen CD45RA (CD4+ CD45RA–).
- Berdasarkan ekspresi PD-1 dan CXCR5, gating pada sel Tph sebagai sel PD-1hi CXCR5. Pada kasus-kasus seperti sampel cairan sinovial, gating sel Tph cukup terlihat jelas dikarenakan cell Tph PF-1hi membentuk kontur visibel (Gam. 1b) (Lihat Catatan 5). Bergantung pada jenis sampel jaringan, Tfh (PD-1+ CXCR5+) dan sel PD-1 negatif (PD-1 CXCR5+/-) juga bisa di-gating.
- Untuk mengkonfirmasi gating sel Tph, analisis komparatif ekspresi CX3CR1 atau CCR2 antara sel-sel Tph, Tfh dan PD-1- dapat dilakukan (Gam. 1c). Dibandingkan dengan sel Tfh, sel tph mengekspresikan kedua reseptor kemokin dengan kadar yang tinggi. Ekspresi BCL6 juga dapat digunakan sebagai pembanding antara sel Tph dan Tfh (Gam. 1d). Dengan ini, sel Tfh mengekspresikan BCL6 dalam kadar tinggi, misalnya pada tonsil, sebaliknya sel Tph mengekspresikannya dalam kadar rendah.
Catatan 3: Sel T CD4+ ditentukan berdasarkan ukurannya yang kecil (FSC-A rendah) dan granularitas rendah (SSC-A rendah).
Catatan 4: Penggunaan FSC atau SSC pada karakter lebar dan tinggi cukup sesuai untuk mendeteksi doublet.
Catatan 5: Menetapkan kadar ekspresi PD-1 dibutuhkan untuk mempertimbangkan “PD-1hi” sel ikut serta dalam beberapa diskresi, khususnya saat menganalisis sel T dari darah. Pada sampel cairan sinovial, kontur yang jelas dari PD-1hi secara relatif dapat diamati (Gam. 1b dan 3a). Suatu populasi sel Tph PD-1hi dapat diamati pada jaringan kanker payudara. Namun, gating sel TCD4+ PD-1hi dari sampel darah sulit untuk dibedakan. Penekanan pada sel dengan ekspresi PD-1 tinggi harus dilakukan untuk dapat merepresentasikan sel Tph. Identifikasi marker tambahan akan lebih memperbaiki proses gating sel Tph, misalnya menggunakan TIGI yang saat ini sedang maraknya untuk dikaji.
c) Assessment Fungsi sel Tph
Disini kami menunjukkan metode untuk melakukan assessment fungsi spesifik sel Tph, termasuk produksi CXCL13 dan kemampuan untuk menginduksi diferensiasi plasmablast. Penyortiran sel dapat dilakukan pada PBMC atau lebih baik pada sel T CD4+ yang telah diisolasi (Lihat Catatan 6). Kami disini memberikan prosedur penyortiran sel pada sel T CD4+ yang telah diisolasi dari PBMC.
Catatan 6: Panel staining diindikasikan pada panel Tabel 1 dapat digunakan untuk menyortir sel Tph jika sampel mengandung berbagai jenis sel mononuklear (misalnya PBMC). Untuk assay yang membutuhkan TCR triggering, direkomendasikan untuk isolasi sel T CD4+ dari jaringan sebelum penyortiran untuk menghindari kebutuhan marker CD3 pada panel tersebut. Jika tidak, staining untuk CD3 dan selanjutnya mengaktivasi sel T dengan antibodi CD3 dapat mencegah aktivasi sel dan proliferasi secara optimal.
d) Isolasi Sel T CD4+
- Setelah proses thawing yang dijelaskan sebelumnya (Bagian: Thawing Sel), 5×107 sel/mL dalam rentang volume 0,25-2 mL dimasukkan ke dalam tabung konikal 12 x 75 mm) round-bottom polistirena (Lihat Catatan 7). Protokol dapat mengacu pada prosedur EasySep™ Human CD4+ T Cell Isolation Kit.
- Tambahkan cocktail isolasi sebanyak 50 μL/mL sampel. Campur secara merata dan inkubasi pada suhu ruang selama 5 menit.
- Vortex vial RapidSpheres™ agar semua partikel terdispersi secara merata selama 30 detik.
- Tambahkan RapidSpheres™ sebesar 50 μL/mL sampel dan campurkan secara merata.
- Tambahkan buffer MACS atau buffer EasySep™ (#20144 StemCell) hingga volume mencapai 2.5 mL. Campurkan secara perlahan dengan pipetting naik-turun sebanyak 2-3 kali. Letakkan tabung tanpa penutupnya (lid atau cap) pada EasySep™ Magnet dan inkubasi pada suhu ruang selama 3 menit.
- Angkat EasySep™ Magnet dan dalam sekali gerak saja balikan magnet dan tabung untuk menuangkan suspensi sel ke tabung baru. Efluen sebagai fraksi negatif yang mengandung sel T CD4+
- Kit isolasi sel ini membutuhkan sekitar 8 menit dengan metode seleksi negatif imunomagnetik.
- Cuci sel segera dengan RPMI 10% FBS untuk menghinglang EDTA (Lihat Catatan 8). Suspensikan kembali pellet sel dalam RPMI 10% FBS dan hitung jumlah sel.
Catatan 7: Langkah ini direkomendasikan ketika sel dicampurkan dengan cocktail antibodi-MACS. Dibanding menggunakan tabung 50 mL, tabung 15 memiliki area lebih terbatas dan memungkinkan kontak optimal antara sel dan antibodi.
Catatan 8: Hindari paparan EDTA secara lama karena dapat menyebabkan sel adheren.
Tabel 2. Panel antibodi flowcytometry multicolor untuk penyortiran sel Tph.
| Antibodi | Klon | Fluorokrom | Brand | Ukuran |
| Live/dead | – | PI | #E-CK-A165 Elabsceince | 100T |
| CD8a | HIT8a | Elab Fluor® 488 | #E-AB-F1271L Elabscience | 100T |
| CD56 | MY31 | Elab Fluor® 488 | #E-AB-F1270L Elabscience | 100T |
| CD19 | CB19 | Elab Fluor® 488 | #E-AB-F1004L Elabscience | 100T |
| CD45RA | HI100 | APC-Cy7 | #100-0317 StemCell | 100T |
| CD25 | BC96 | FITC | #E-AB-F1194C Elabscience | 100T |
| CD127 | A019D5 | Alexa Fluor® 700 | #351344 Biolegend | 100T |
| PD-1 | EH12.2H7 | Brilliant Violet 711 | #329928 Biolegend | 100T |
| CXCR5 | J252D4 | Brilliant Violet 421 | #356920 Biolegend | 100T |
1) Staining Flow Cytometry untuk Penyortiran Sel
- Cuci sel dengan buffer sorting FACS dan sentrifugasi pada 1500 rpm (483×g) selama 5 menit.
- Dalam volume kecil, inkubasi sampel selama 20 menit pada suhu ruang dan selanjutnya dengan antibodi pada panel Tabel 2 pada 4°C, kecuali Live/dead PI. Campurkan sel secara merata.
- Ulangi langkah 1.
- Suspensikan kembali sel pada 20 juta/mL di dalam tabung polypropylene. Sebelum penyortiran sel, tambahkan staining Live/dead PI seperti yang telah disebutkan. Campurkan sel secara merata.
2) Strategi Gating untuk Penyortiran Sel Tph
- Pindahkan sel ke dalam 1,5 mL FACS tabung staining polistirena. Cuci dengan PBS dan sentrifugasi pada 1500 rpm (483×g) selama 5 menit.
- Inkubasi sampel selama 20 menit pada suhu 4°C dengan Live/dead PI dalam 100 μL PBS.
- Gating pada sel hidup (Live/dead PI–). Sel-sel hidup dapat diplot pada SSC-A atau pada FSC-A.
- Gating pada sel memori (CD45RA–) tanpa marker spesifik-lineage CD8 (sel T CD8+), CD19 (sel B), dan CD56 (sel NK).
- Keluarkan populasi sel Treg yang mengekspresikan CD25 dalam kadar tinggi dan CD127 dalam kadar sangat rendah (sel CD25hi CD127dim) dan gating sisa populasi non-Treg (Lihat Catatan 9).
- Berdasarkan ekspresi PD-1 dan CXCR5, gating dan penyortiran sel Tph diidentifikasi sebagai PD-1hi CXCR5–. Sebagai contoh strategi gating untuk menyortir sel dari sel T CD4+ total ditunjukkan (Gambar 2).
- Sel harus dicuci dengan RPMI 10% FBS dan disentrifugasi sebanyak 2 kali sebelum dikulturkan.
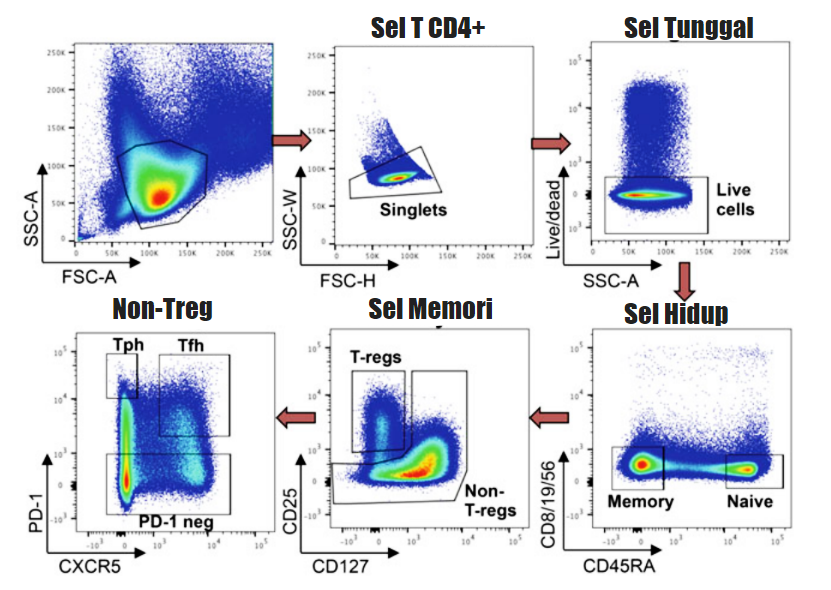
Gambar 2. Strategi gating untuk menyortir sel Tph dari total sel T CD4+ murni dengan MACS dari darah.
Catatan 9: Saat menganalisa sel T dari darah, langkah ini bersifat opsional karena Treg pada darah biasanya tidak mengekspresikan PD-1 dan akhirnya juga gating negatif PD-1. Untuk membandingkan populasi sel Tph dengan populasi lainnya seperti Th1 dan Th17, marker untuk CXCR3 dan CCR6 dapat ditambahkan pada panel (Gambar 2). Sel Th17 dideskripsikan sebagai sel CCR6+ CXCR3- sedangkan Th1 sebagai sel T CCR6- CXCR3+.
3) Staining Intracellular pada Sel yang Disortir dan Strategi Gating
- Untuk mengukur karakteristik fungsional sel Tph manusia, deteksi intraseluler CXCL13 merupakan salah satu opsi (Lihat Catatan 10). Setelah penyortiran sel Tph, stimulasi sel dengan Dynabeads Human T-Activator CD3/CD28 selama 24 jam pada media lengkap (Lihat Catatan 11).
- Tambahkan brefeldin A (#ab120299, #ab193369 Abcam) pada sumuran dan inkubasi selama 4 jam.
- Lanjutkan dengan protokol staining standar yang telah dijelaskan sebelumnya. Untuk staining intraseluler, inkubasi sampel dengan antibodi (misalnya, CXCL13 dan IL-2) selama 30 menit pada suhu 4°C dalam buffer permeabilisasi (Lihat Catatan 12).
- Selama analisis, aplikasikan strategi gating yang sama seperti yang telah dijelaskan sebelumnya dalam identifikasi sel T. Selanjutnya, ekspresi CXCL13 atau sitokin lainnya pada sel tersortir dapat diidentifikasi.
Catatan 10: Teknik lain dapat digunakan untuk mendeteksi protein CXCL13 (#E-EL-H0053 Elabscience) dan IL-21 (#E-EL-H2450 Elabscience), termasuk analisis supernatan menggunakan metode ELISA. Untuk running ELISA, sel harus distimulasi selama 1-3 hari sebelum pengambilan supernatan.
Catatan 11: Untuk menstimulasi sel dengan Dynabeads, rasio yang digunakan antara bead/sel yaitu 1:5. Sebagai contoh, 1 juta sel distimulasi dengan 5 μL Dynabeads. Sebagai alternatif, plate dengan antibodi anti-CD3 dan soluble anti-CD28 yang telah di-coating juga dapat digunakan.
Catatan 12: Foxp3/Transcription Factor Staining Kit (#E-CK-A108 Elabscience) dapat digunakan baik untuk staining intranuklear dan intraselular. Perbedaan diantara kedua staining assay adalah waktu inkubasi antibodi (30 vs 60 menit) dan kondisi suhu (4°C vs suhu ruang).
Tabel 3. Panel antibodi flowcytometry multicolor untuk penyortiran sel Tph.
| Antibodi | Klon | Fluorokrom | Brand | Ukuran |
| Live/dead | – | PI | #E-CK-A165 Elabscience | 100T |
| CD3 | UCHT1 | PE-Cy7 | #E-AB-F1230H Elabscience | 100T |
| CD14 | M5E2 | APC | #E-AB-F1209E Elabscience | 100T |
| CD27 | O323 | FITC | #E-AB-F1140C Elabscience | 100T |
| IgD | IA6-2 | Elab Fluor® Violet 450 | #E-AB-F1171Q Elabscience | 100T |
| CD19 | HI19a | Elab Fluor® Violet 450 | #E-AB-F1304Q Elabscience | 100T |
| CD38 | HIT2 | PE/Cyanine7 | #E-AB-F1058H Elabscience | 100T |
4) Kokultur sel T dengan Sel B Memori
- Sel Tph dapat diisolasi dan disortir sesuai protokol yang telah dideskripsikan diatas (Bagian: Isolasi Sel T CD4+).
- Untuk isolasi sel B, ikuti langkah 1 dari isolasi sel T (Bagian: Isolasi Sel T CD4+). Berikutnya, suspensikan kembali pellet sel dengan buffer MACS dengan volume total 80 μL/10 juta sel mononuklear. Tambahkan cocktail isolasi sebanyak 50 μL/mL sampel. Campur secara merata dan inkubasi pada suhu ruang selama 5 menit. Vortex vial RapidSpheres™ agar semua partikel terdispersi secara merata selama 30 detik. Tambahkan RapidSpheres™ sebesar 50 μL/mL sampel dan campurkan secara merata. Tambahkan buffer MACS atau buffer EasySep™ (#20144 StemCell) hingga volume mencapai 2.5 mL. Campurkan secara perlahan dengan pipetting naik-turun sebanyak 2-3 kali. Letakkan tabung tanpa penutupnya (lid atau cap) pada EasySep™ Magnet dan inkubasi pada suhu ruang selama 3 menit. Angkat EasySep™ Magnet dan dalam sekali gerak saja balikan magnet dan tabung untuk menuangkan suspensi sel ke tabung baru. (Opsi: ambilah fraksi negatif). Untuk seleksi sel B positif, tabung ditransfer ke tabung koleksi. Tambahkan 1 mL buffer MACS dan langsung keluarkan sel B terlabel magnetik.
- Untuk menyeleksi sel B memori, staining sel dengan panel cocktail pada Tabel 3.
- Gating pada sel hidup (Live/dead PI–). Sel hidup dapat diplot pada SSC-A atau FSC-A.
- Untuk menyeleksi dan menyortir sel B memori, gating pada populasi yang tidak mengekspresikan CD14 dan CD3. Selanjutnya, gating dan sortir sel B memori (CD27+ IgD–). Sel harus dicuci dengan RPMI 10% FBS dan disentrifugasi sebanyak 2 kali sebelum dikultur.
- Kokultur sel Tph atau populasi sel T lainnya dengan sel B memori pada rasio 1:10 (sel T: sel B) dalam media lengkap dan stimulasi dengan SEB (1 μg/mL) selama 5–7 hari. Setelah harvesting dan staining plasmablast, kemampuan sel Tph menginduksi sel B untuk memperoleh fenotip plasmablast (CD38high CD27high) dapat dideterminasi setelah gating pada sel CD19+ CD4– (Lihat Catatan 13). (Gambar 3).
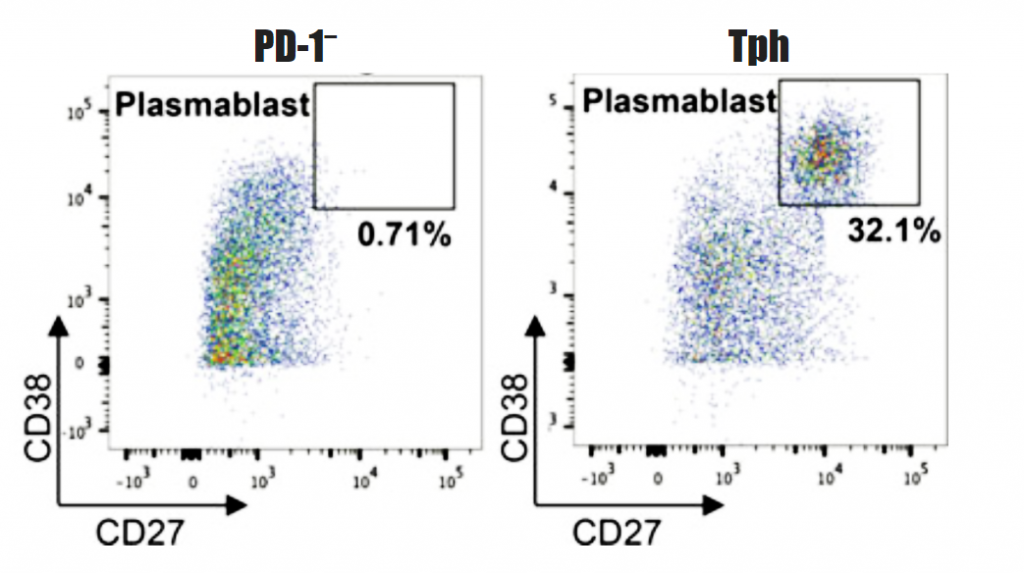
Gambar 3. Deteksi plasmablast CD38hi CD127+ di antara sel CD19+ dalam kokultur sel Tph atau sel T CD4+ PD-1– memori yang dikultur dengan sel B memori tersortir.
Catatan 13: Komparasi terhadap populasi sel Tfh PD-1+ CXCR5+ disortir berguna sebagai kontrol positif.
C. Referensi
- Waisman A, Becher B (Eds.). 2014. T-Helper Cells: Methods and Protocols. Humana Press.
- Graca L (Ed). 2022. T-Follicular Helper Cells: Methods and Protocols. Humana Press.
- Ono M (Ed). 2023. Regulatory T-Cells: Methods and Protocols. Humana Press.
- Zheng S-G (Ed). 2021. T Regulatory Cells in Human Health and Diseases. Springer.
D. Artikel Terkait
- Introduksi Flow Cytometer dan Prinsip Kerjanya [Link]
- Prosedur Flow Cytometry dan Seleksi Jenis Antibodi Flow Cytometry [Link]
- Bagaimana Memilih Antibodi untuk Flow Cytometry [Link]
- Cell Line Merk Elabscience [Link]
- Prosedur Dasar Laboratorium untuk Pemeliharaan Kultur Sel [Link]
- 4 Metode Mengukur Proliferasi Sel [Link]
- 6 Alasan Memilih Kit Deteksi Apoptosis Annexin V Merk Elabscience® [Link]
- 4 Alasan Memilih Kit Cell Proliferation and Toxicity Merk Elabscience® [Link]
- 5 Alasan Memilih Kit TUNEL Assay Merk Elabscience® [Link]