Perbedaan Sel Kultur Adheren dan Suspensi
Sel kultur merupakan teknik yang digunakan untuk menumbuhkan dan mempertahankan sel-sel hidup pada lingkungan yang terkontrol di dalam laboratorium. Ini memungkinkan para ilmuwan untuk mempelajari perilaku sel, menjalankan uji obat, dan bahkan menghasilkan produk bioteknologi seperti vaksin dan terapi gen. Dalam sel kultur, sel-sel dapat ditempatkan dalam dua bentuk utama: adheren dan suspensi.
Perbedaan antara Sel Adheren dan Suspensi
Adherent Cells
Sel adheren melekat erat pada permukaan substrat, biasanya dalam cairan pertumbuhan yang melekat pada permukaan cawan petri atau botol sel kultur. Mereka umumnya bersentuhan langsung dengan substrat, yang biasanya terbuat dari plastik atau gel seperti agarosa. Contoh sel adheren termasuk sel epitelial dan fibroblas.
Suspension Cells
Sel suspensi melayang bebas di dalam cairan pertumbuhan dan tidak melekat pada substrat. Mereka sering dikultur dalam bioreaktor atau dalam media cair yang diaduk untuk memastikan distribusi nutrien dan oksigen yang merata. Sel darah, sel limfosit, dan beberapa jenis sel kanker adalah contoh dari sel suspensi.
Teknik Sel Kultur Adheren dan Suspensi
Menumbuhkan sel kultur dengan membedakan sel adheren dan suspensi melibatkan pendekatan yang sedikit berbeda karena sifat dan kebutuhan pertumbuhan keduanya berbeda. Berikut adalah langkah-langkah umum untuk menumbuhkan kedua jenis sel dalam kultur:
| Tahapan Proses | Sel Adheren | Sel Suspensi |
| Menyiapkan Medium | Persiapkan media kultur yang cocok untuk jenis sel yang akan digunakan. Media ini harus mengandung nutrien yang diperlukan seperti gula, garam, asam amino, dan faktor pertumbuhan. Media basal yang paling umum digunakan diantaranya: DMEM, MEM, Ham’s F-12, RPMI 1640. Medium basal perlu penambahan suplemen seperti Fetal Bovine Serum (FBS) sebagai faktor pertumbuhan sel dan antibiotik (Penicillin-Streptomycin) untuk mencegah adanya kontaminasi bakteri atau jamur. | |
| Resusitasi Sel Beku (Frozen cell) | – Pastikan vial berisi sel dalam tangki nitrogen atau dry ice sampai sel siap untuk diresusitasi.
– Pindahkan vial secara cepat pada waterbath dengan suhu 37ºC (1-2 menit). Pindahkan sel ke dalam tabung steril lebih besar (tube 15ml) dengan penambahan medium komplit yang sebelumnya sudah dihangatkan (37ºC). Sentrifugasi dengan kecepatan 100-150 x g selama 5 menit. Sentrifugasi dilakukan untuk membuang residu krioprotektan. – Tambahkan pellet sel yang telah disentrifugasi dengan medium baru, dan lakukan perhitungan serta viabilitas sel. – Jumlah kepadatan Sel adheren umumnya 1 x 105 cell per 10ml pada cawan petri. Adapun kisaran volume media kultur pada flask dengan ukuran: flask 25 cm2 5-10ml; flask 75 cm2 25–35ml; flask 175 cm2 40-50ml. – Khusus suspensi sel direkomendasikan maksimal jumlah sel 5-7 x 105 cells/ml untuk seeding. – Inkubasi sel pada suhu 37ºC dan 5% CO2. |
|
| Subkultur | – Amati sel dengan mikroskop untuk melihat konfluensinya. Sel siap untuk subkultur jika mencapai konfluen 70-80%.
– Buang medium dalam dish atau flask secara hati-hati. – Masukan PBS tanpa Ca2+/Mg2+ untuk bilasi permukaan wadah dengan volume setengah dari medium sebelumnya. – Buang PBS dan tambahkan Trypsin EDTA 3ml (flask 25 cm2 pada permukaan layer. Usahakan trypsin merata pada monolayer flask. – Masukan flask ke dalam inkubator selama 2-10 menit. – Periksa sel menggunakan mikroskop inverted untuk memastikan bahwa semua sel terlepas dan mengambang. Sisi flask dapat diketuk secara perlahan untuk melepaskan sel-sel yang menempel. – Pindahkan sel ke dalam tabung sentrifuge dan bilas dengan medium komplit. – Sentrifugasi pada 1000rpm selama 5 menit dan buang supernatan. – Tambahkan kembali medium komplit sebanyak 5 ml. – Lakukan perhitungan sel. – Pindahkan sel dengan jumlah yang dibutuhkan ke dalam flask baru berisi medium komplit hangat. – Inkubasi sel pada inkubator CO2. |
– Amati sel dengan mikroskop untuk melihat konfluensinya. Sel siap untuk subkultur jika mencapai konfluen 70-80%.
– Pindahkan sel beserta medium kedalam tabung sentrifugasi, sentrifugasi 100-150 x g atau 1000rpm selama 5 menit dan buang supernatan. – Tambahkan kembali medium komplit sebanyak 5 ml. – Lakukan perhitungan sel. – Pindahkan sel dengan jumlah yang dibutuhkan ke dalam flask baru berisi medium komplit hangat. – Inkubasi sel pada inkubator CO2.
|
| Catatan: Ketika sel-sel mencapai kepadatan tertentu, sel perlu dipindahkan ke wadah yang lebih besar atau dibagi menjadi wadah yang lebih kecil untuk mencegah kelebihan pertumbuhan dan kematian sel. | ||
| Kriopreservasi | – Siapkan medium freezing: Medium complete + 5-10% DMSO (penggunaan DMSO dapat diganti dengan krioprotektan lain).
– Pastikan sel konfluen 70-80%, amati pada mikroskop. – Disosiasi sel dengan prosedur standar. – Sentrifugasi pada kecepatan tertentu selama 5 menit dan buang supernatan. – Tambahkan medium freezing, dan dapatkan konsentrasi sel akhir sekitar 5 x 105 – 1 x 107 cell/ml. – Masukan suspensi sel ke dalam tabung kriopreservasi. – Simpan vial dalam Mr Frosty dan pindahkan ke Freezer -80ºC selama 24 jam. Setelah 24 jam pindah vial ke dalam Cryotank berisi LN2. Idealnya dapat menggunakan rate-controlled freezer terprogram. |
Cara Perhitungan Sel Kultur
1. Resuspensi cell pada tabung, ambil 100uL cell ke dalam microtube
Dilusi 10x:
Cell suspension : 100uL
PBS : 800uL
0.4%-Trypan Blue Stain Solution : 100uL
| Brand | No. Katalog | Deskripsi | Size |
| Elabscience | PB180423 | 0.4% Trypan Blue Solution | 100 ml |
2. Resuspensi cell dan ambil 10uL ke bawah coverslip Hemocytometer

3. Amati cell pada inverted Microscope. Hitung cell hidup (tidak berwarna, cerah dibawah fase kontras) dan mati (berwarna biru). Cara penghitungan hemocytometer, tentukan dahulu sisi mana yang akan dihitung, jika menghitung pada sisi atas kanan, makan sisi bawah dan kiri garis tidak dihitung.
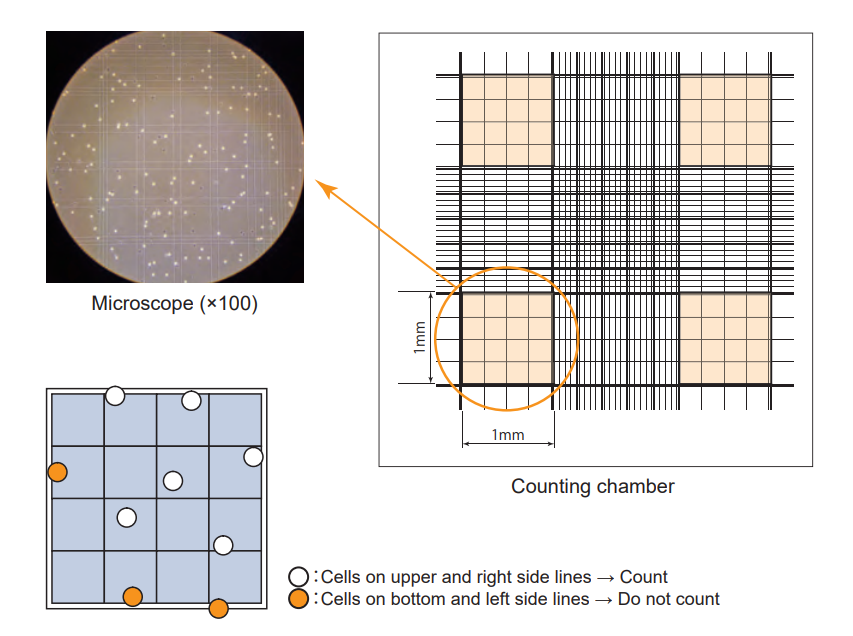
4. Menghitung cell
Jumlah sel per ml : Total jumlah sel terhitung / Jumlah partisi yang dihitung (large corner square) x rasio pengenceran x 104
Jumlah sel total : Jumlah sel per ml x volume suspensi
%Viability sel : Jumlah sel hidup / jumlah sel total x 100%
Contoh:
Volume suspensi: 5ml
Rasio pengenceran: 10x
Jumlah partisi/large corner square : 4
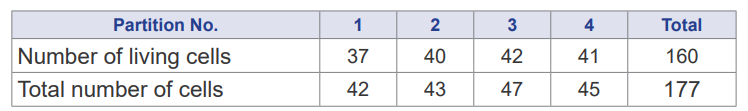
Jumlah sel : 160/4 x 10 x 104 = 4 x 106 cell/ml
Total sel : 4 x 106 x 5ml = 2 x 107
%Viability sel : 160/170 x 100% = 90%
Baca juga artikel terkait sel kultur berikut:
Mengenal Dasar-Dasar Kultur Sel Kanker
Prosedur Dasar Laboratorium untuk Pemeliharaan Kultur Sel
Cell line untuk Penelitian SARS-CoV-2 dari Merk Elabscience
Sumber:
1. UK Health Security Agency. Cell culture protocols. Website: https://www.culturecollections.org.uk/training-and-support/technical-support/cell-culture-protocols/. 19 April 2024; 20.00 WIB.
2. Nacalai-tesque. Cell Cultivation Handbook ver 2.2.

