Prosedur Dasar Laboratorium untuk Pemeliharaan Kultur Sel
1. Pemisahan Sel Adheren dari Vessel untuk Subkultur
Sel yang dikultur secara in vitro akan menghabiskan nutrien medium, mengeluarkan metabolit toksik dan bertumbuh dengan pesat. Guna memperluas dan mempertahankan kultur sel untuk tetap sehat, penting untuk menghasilkan subset kultur baru, menghilangkan metabolit toksik dan menambahkan kembali media segar. Waktu tepat untuk passaging sel yaitu saat konfluensi (pertemuan atau persentase penutupan permukaan vessel) mencapai ~80% pada vessel. Sel adheren dapat dicerna secara enzimatik atau dipisahkan secara mekanis dari substrat (misalnya, flask atau petri). Pada BSC, sel dicuci dengan PBS bebas Mg2+ dan Ca2+ untuk menghilangkan sel mati (non-adheren) dan diinkubasi pada 37°C dengan enzim digestif atau zat pengkelat hingga menutupi monolayer sel (misalnya, trypsin, dispase, kolagenase, EDTA). Sekitar 1-60 menit yang diperlukan untuk melepaskan sel dari substrat, nanum lama pemisahan bergantung pada jenis sel dan enzim digestif yang digunakan.
Tingkat disosiasi dapat diamati dibawah mikroskop cahaya dan pengetokkan vessel akan memisahkan sisa sel yang masih menempel. Sel-sel yang berhasil terpisah dikumpulkan dalam tabung centrifuge conical steril dan vessel juga harus dicuci dengan media dengan inhibitor untuk enzim digestif dan agen disosiasi sel. Sel-sel dapat dikonsentrasikan dan dihitung serta ditumbuhkan pada vessel baru pada konsentrasi yang diinginkan. Konsentrasi sel yang lebih rendah (~104 sel/mL) sesuai untuk cell line dengan laju proliferasi cepat, sedangkan konsentrasi sel lebih tinggi (~105 sel/mL) lebih sesuai untuk sel dengan laju pertumbuhan yang lebih lambat.
Tabel 1. Reagen disosiasi sel dari substrat pada vessel
| Produsen | Katalog | Reagen Disosiasi Sel | Ukuran |
| Elabscience | PB180225 | 0.25% Trypsin Solution | 100mL |
| Elabscience | PB180226 | 0.25% Trypsin Solution (with EDTA, phenol red, dissolved in D-Hank’s) | 100mL |
| Elabscience | PB180228 | 0.25% Trypsin Solution (dissolved in PBS) | 100mL |
| Elabscience | PB180221 | 0.05% Trypsin Solution (with EDTA, dissolved in D-Hank’s) | 100mL |
| Elabscience | PB180320 | 0.02% EDTA Solution (Versene Solution) | 100mL |
| Elabscience | PB180620 | 0.5% EDTA Solution | 100mL |
| StemCell | 7416 | Collagenase Type I | 1g |
| StemCell | 100-0677 | Collagenase Type I | 5g |
| StemCell | 7446 | Dispase, ACF | 10mg |
| StemCell | 7449 | DisCoZyme 1, ACF | 50mg |
| StemCell | 7450 | DisCoZyme 2, ACF | 50mg |
| StemCell | 7913 | Dispase (5 U/mL), in Hanks’ Balanced Salt Solution | 100mL |
| StemCell | 7923 | Dispase (1 U/mL), in DMEM/F-12 | 100mL |
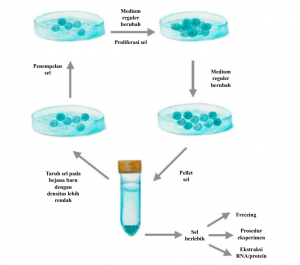
Gambar 1. Alur pemeliharaan sel. Cell line adheren dapat dipelihara pada flask atau petri dan perubahan media secara reguler harus dilakukan untuk memastikan perbanyakan sel. Apabila konfluensi mencapai ~ 80%, sel-sel dipisahkan secara enzimatik atau mekanis dari substrat. Sel-sel yang telah terlepas dapat dikoleksi dalam tabung kerucut dan dijadikan pelet. Dengan subset ini, vassel baru dapat ditanamkan dan sel yang tersisa dapat dibekukan atau digunakan untuk eksperimen berikutnya.
Catatan: Penting untuk selalu mencatat jumlah pasassaging yang telah dilakukan sejak kultur dimulai. Beberapa cell line tidak sesuai untuk eksperimen diluar jumlah passaging karena kecenderungan peningkatan abnormalitas kromosom pada cell line mamalia dengan pembelahan sel konstan.
Tabel 2. Jenis consumables yang digunakan pada kultur sel dengan produk JetBiofil
| JetBiofil | Consumables untuk Kultur Sel | Ukuran |
| PP101030 | Transfer Pipets 3.0ml, Sterilized | 200ea |
| GSP110010 | Serological Pipets 10ml, 1/10 ml, Sterilized, Orange, Individually Wrap | 50ea |
| CFT511150 | Centrifuge Tubes 15ml, Plug Seal Cap, Conical, Sterilized | 25ea |
| CFT921150 | Centrifuge Tubes 15ml, PP, 20000×g, Conical-Bottom, Sterilized, Flat Cap w/ Sealing Ring | 25ea |
| CFT211150 | Centrifuge Tubes 15ml, EasyFlip™, Conical, Flip Top Cap, Sterilized | 25ea |
| CFT511500 | Centrifuge Tubes 50ml, Plug Seal Cap, Conical, Sterilized | 25ea |
| CFT613500 | Centrifuge Tubes 50ml, Self-Standing, Resealable Bag, Plug Seal Cap, Sterilized, Dnase/Rnase-free | 25ea |
| CFT921500 | Centrifuge Tubes 50ml, PP, 20000×g, Conical-Bottom, Sterilized, Flat Cap w/ Sealing Ring | 25ea |
| CAD010060 | TC Dishes 6 cm, CellATTACH Surface Treated, Dnase/Rnase-free, Non-pyrogenic, Sterilized | 10ea |
| CAD010090 | TC Dishes 9 cm,CellATTACH Surface Treated, Dnase/Rnase-free, Non-pyrogenic, Sterilized | 10ea |
| MCD000090 | Petri Dishes 9 cm, Sterilized | 10ea |
| CAF011050 | TC Flasks 50ml, 25cm2, CellATTACH Surface Treated, Plug Seal Cap, Dnase/Rnase-free, Non-pyrogenic, Sterilized | 10ea |
| CAF012050 | TC Flasks 50ml, 25cm2, CellATTACH Surface Treated, Vent Cap, Dnase/Rnase-free, Non-pyrogenic, Sterilized | 10ea |
| CAP011006 | Plates 6-well, CellATTACH Surface Treated, Dnase/Rnase-free, Non-pyrogenic, Sterilized | 10ea |
| CAP011012 | Plates 12-well, CellATTACH Surface Treated, Dnase/Rnase-free, Non-pyrogenic, Sterilized | 10ea |
| CAP011024 | Plates 24-well, CellATTACH Surface Treated, Dnase/Rnase-free, Non-pyrogenic, Sterilized | 10ea |
| CAP011048 | Plates 48-well, CellATTACH Surface Treated, Dnase/Rnase-free, Non-pyrogenic, Sterilized | 10ea |
| CAP011096 | Plates 96-well, CellATTACH Surface Treated, Dnase/Rnase-free, Non-pyrogenic, Sterilized | 10ea |
| TCP011896 | TC Plates 96-well, Surface Treatment, Detachable, 8×12, Sterile, In Plastic Blister Packed | 10ea |
2. Subkultur Suspensi Kultur
Subkultur suspensi kultur dapat dilakukan dengan membuang sepertiga larutan suspensi sel secara aseptik dan mengganti volume tersebut dengan complete media yang telah dihangatkan sebelumnya.
3. Pembuatan Pelet Sel
Suspensi sel disentrifugasi pada 300×g selama 10 menit untuk mengkonsentrasikan sel, guna dipindahkan ke vessel baru, freezing atau eksperimen lainnya. Setelah supernatan dikeluarkan, pelet sel disuspensikan kembali dalam media melalui pemipetan sel atas-bawah secara perlahan sebanyak tiga kali.
Catatan: Sentrifugasi pada kecepatan tinggi dan pemipetan secara kuat sangat disarankan, karena sel tunggal umumnya sangat rapuh.
4. Kuantifikasi Sel dan Penentuan Viabilitas Sel
Selama proses pengiriman atau handling, sel dapat mati karena sifatnya yang sangat sensitif kondisi kimia, suhu dan waktu. Saat mengandalkan konsentrasi sel hidup tertentu untuk memulai kultur atau membutuhkan sejumlah sel hidup untuk pengujian tertentu, penting untuk mampu membedakan antara sel hidup dan sel mati. Penghitungan sel juga dapat berkontribusi dalam menilai laju pertumbuhan.
Untuk menghasilkan jutaan kultur sel, jumlah sel pertama dihitung dalam volume kecil dan kemudian diperluas hingga volume sel penuh. Demi mencapai hal ini, semua sel dipisahkan, dipelet dan disuspensikan kembali secara merata dalam volume media yang sesuai. Dalam pengenceran 1:1 dengan 0,4% trypan Blue, jumlah kecil suspensi sel dicampur dalam tabung conical dengan memasukkan 10µL campuran sel dalam Trypan Blue ke hemasitometer. Pewarna Trypan Blue selanjutnya hanya mempenetrasi sel-sel nonviable (mati) sehingga dapat dikeluarkan dari kuantifikasi selanjutnya. Pengamatan dapat dilakukan dengan inverted microscope, fase kontras dan perbesaran minimal 10X, untuk semua sel yang terletak di empat kotak terluar dapat dihitung. Sel viable (hidup) menunjukkan adanya “halo” lebih gelap, sedangkan sel mati berwarna biru/hitam.
Penentuan jumlah sel hidup yaitu dengan perhitungan jumlah sel di keempat kotak dan penentuan jumlah rata-rata dalam 1 mm2, dikalikan dengan 104 (untuk mendapatkan jumlah sel per mL), dikalikan dengan 2 (untuk memperhitungkan faktor pengenceran Trypan Blue) serta dikalikan dengan volume media awal dari seluruh suspensi sel. Persentase sel hidup dapat ditentukan dengan membagi jumlah sel tidak diwarnai dengan jumlah total sel, dan mengalikan rasionya dengan 100. Kultur sel sehat ditandai dengan persentase viabilitas sel berkisar 80–95%.
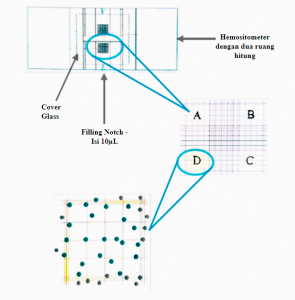
Gambar 2. Determinasi viabilitas sel menggunakan Trypan Blue. Hemasitometer disiapkan dengan menutupi kedua kamar hitung dengan cover glass. Sebanyak 10μL suspensi sel perbandingan 1:1 dengan 0,4% Trypan Blue dimasukan ke filling notch satu ruang hitung. Campuran tersebut akan mengisi kisi-kisi yang dapat diamati dalam inverted microscope pada perbesaran minimal 10X. Rata-rata sel yang menutupi kotak A–D dapat menunjukkan jumlah sel per mm2. Sel-sel viable dalam kotak dihitung dengan mengecualikan sel-sel nonviable berwarna hitam. Hanya sel yang overlapping dengan salah satu batas horizontal dan vertikal luar yang dihitung, sel di luar itu tidak dihitung.
Tabel 3. Deteksi proliferasi sel, sitotoksisitas, viabilitas sel kultur dengan produk Elabscience
| Katalog | Deskripsi Produk | Ukuran |
| PB180423 | 0.4% Trypan Blue Solution | 100mL |
| PB180519 | 5 mg/mL MTT solution | 1mL×5 |
| E-CK-A341 | MTT Cell Proliferation and Cytotoxicity Assay Kit | 500T |
| E-CK-A370 | E-Click EdU Cell Proliferation Flow Cytometry Assay Kit (Green,FITC) | 50T / 200T |
| E-CK-A371 | E-Click EdU Cell Proliferation Flow Cytometry Assay Kit (Green, Elab Fluor® 488) | 50T / 200T |
| E-CK-A373 | E-Click EdU Cell Proliferation Flow Cytometry Assay Kit (Red, Elab Fluor® 647) | 50T / 200T |
| E-CK-A375 | E-Click EdU Cell Proliferation Imaging Assay Kit (Green,FITC) | 50T / 200T |
| E-CK-A376 | E-Click EdU Cell Proliferation Imaging Assay Kit (Green, Elab Fluor® 488) | 50T / 200T |
| E-CK-A377 | E-Click EdU Cell Proliferation Imaging Assay Kit (Red, Elab Fluor® 594) | 50T / 200T |
| E-CK-A378 | E-Click EdU Cell Proliferation Imaging Assay Kit (Red, Elab Fluor® 647) | 50T / 200T |
| E-CK-A211 | Annexin V-FITC/PI Apoptosis Kit | 100T |
| E-CK-A351 | Cell Cycle Assay Kit (Red Fluorescence) | 100T |
| E-CK-A362 | Enhanced Cell Counting Kit 8 (WST-8/CCK8) | 100T / 500T |
| E-BC-K771-M | Lactate Dehydrogenase (LDH) Cytotoxicity Colorimetric Assay Kit | 96T |
| E-CK-A320 | One-step TUNEL In Situ Apoptosis Kit (Green, FITC) | 100T |
| E-CK-A321 | One-step TUNEL In Situ Apoptosis Kit (Green, Elab Fluor® 488) | 100T |
| E-CK-A322 | One-step TUNEL In Situ Apoptosis Kit (Red, Elab Fluor® 594) | 100T |
| E-CK-A324 | One-step TUNEL In Situ Apoptosis Kit (Red, Elab Fluor® 647) | 100T |
| E-CK-A325 | One-step TUNEL In Situ Apoptosis Kit (Red, Elab Fluor® 555) | 100T |
| E-CK-A420 | One-step TUNEL Flow Cytometry Apoptosis Kit (Green, FITC) | 100T |
| E-CK-A421 | One-step TUNEL Flow Cytometry Apoptosis Kit (Green, Elab Fluor® 488) | 100T |
| E-CK-A422 | One-step TUNEL Flow Cytometry Apoptosis Kit (Red, Elab Fluor® 594) | 100T |
| E-CK-A423 | One-step TUNEL Flow Cytometry Apoptosis Kit (Blue, Elab Fluor® Violet 450) | 100T |
| E-CK-A424 | One-step TUNEL Flow Cytometry Apoptosis Kit (Red, Elab Fluor® 647) | 100T |
| E-CK-A425 | One-step TUNEL Flow Cytometry Apoptosis Kit (Red, Elab Fluor® 555) | 100T |
| E-CK-A331 | TUNEL In Situ Apoptosis Kit (HRP-DAB Method) | 100T |
| E-CK-A121 | Annexin V-Cyanine5 Reagent | 200T / 500T |
| E-CK-A119 | Annexin V-EGFP Reagent | 200T / 500T |
| E-CK-A110 | Annexin V-Biotin Reagent | 200T / 500T |
| E-CK-A115 | Annexin V-PE Reagent | 200T / 500T |
| E-CK-A117 | Annexin V-APC Reagent | 200T / 500T |
| E-CK-A111 | Annexin V-FITC Reagent | 200T / 500T |
| E-CK-A123 | Annexin V-PE/Cyanine5 Reagent | 200T / 500T |
| E-CK-A125 | Annexin V-PE/Cyanine5.5 Reagent | 200T / 500T |
| E-CK-A127 | Annexin V-PE/Cyanine7 Reagent | 200T / 500T |
| E-CK-A129 | Annexin V-APC/Cyanine7 Reagent | 200T / 500T |
| E-CK-A354 | Calcein AM/PI Double Staining Kit | 100T / 500T |
| E-CK-A164 | Calcein AM Solution(100 µM) | 100T / 500T |
| E-CK-A165 | PI Solution(750 µM) | 100T / 500T |
| E-CK-A153 | Calcein AM Assay Buffer | 500mL |
Tabel 4. Perhitungan sel dengan hemacytometer Neubauer dari Marienfeld
| Katalog | Deskripsi Produk | Ukuran |
| 0610010 | Counting Chamber – Neubauer improved (dark line) | Unit |
5 Pembekuan (Freezing) Sel
Jika sel berlebih selama subkultur, sel dapat disimpan dengan malukan pembekuan atau freezing dengan zat krioprotektan (misalnya, gliserol atau DMSO) yang mampu mencegah pembentukan kristal ekstra atau intraseluler yang berbahaya bagi sel. Sel yang terpisah dan dijadikan pelet kemudian disuspensikan kembali dalam 1 mL freezing medium (misalnya, knockout serum replacement medium yang dilengkapi 10% DMSO) dan ~1×106 sel dipindahkan ke cryovial. Setelah 20-30 menit, krioprotektan akan mempenetrasi sel dan selanjutnya dibekukan semalaman pada suhu −80°C dengan laju pembekuan terkontrol 1–2°C/menit, vial kemudian dipindahkan ke nitrogen cair untuk penyimpanan jangka panjang.
Catatan: Gliserol dan DMSO merupakan zat krioprotektan yang sesuai untuk penyimpanan beku sel, namun penanganan DMSO harus sangat diperhatikan dan dilakukan secara hati-hati. DMSO konsentrat bersifat toksik bagi personel laboratorium dan sel sehingga harus diencerkan sebelumnya. Toksisitas ini juga dapat berdampak negatif pada sel dengan media mengandung 10% DMSO, ketika dibiarkan beberapa jam pada suhu ruang, maka diwajibkan untuk mentransfer sel ke suhu -80°C untuk penyimpanan dalam waktu 30 menit. Secara umum, tata tertib penggunaan pakaian dan gloves laboratorium mampu melindungi personel dari bahaya DMSO dan zat terlarut.
Tabel 5. Reagent pada proses pembekuan atau freezing sel dengan produk Elabscience
| Katalog | Medium Pembekuan Sel | Ukuran |
| PB180438 | Freezing Medium (Serum-free & animal origin-free) | 100mL |
| PB180436 | General Freezing Medium | 10mL×10 |
| P-CC-001 | Room SafeGuard | 480mL |
| P-CC-002 | Bath SafeGuard | 100mL |
6 Pencairan (Thawing) Sel Kriopreservasi
Sebagian besar sel mamalia dapat disimpan dalam jangka panjang pada nitrogen cair (<130°C) hingga bertahun-tahun karena penghentian proses biologis. Untuk memulihkan kondisi sel, 10 mL complete media dihangatkan dengan waterbath. Setelah mengeluarkan vial beku dari nitrogen cair, harus segera dimasukkan ke waterbath 37°C dan diputar perlahan hingga dua pertiga isinya mencair. Vial diusap dengan etanol 70% dan ditempatkan dalam BSC di mana 1 mL media yang telah dihangatkan sebelumnya ditambahkan tetes demi tetes ke vial untuk meminimalkan tekanan osmotik. Ketika semua Isi vial sudah mencair, kemudian dipindahkan tetes demi tetes ke 9 mL complete media sisanya dan disentrifugasi pada 300×g selama 3 menit. Setelah supernatan diaspirasi, pelet sel dapat dicuci sekali dalam media untuk menghilangkan sisa zat kriopreservatif. Sel kemudian disuspensikan kembali dalam complete media dan dipindahkan ke vessel. Penempelan sel harusnya dapat terjadi dalam 24 jam.
Catatan: Viabilitas sel setelah kriopreservasi dipengaruhi oleh kemampuannya untuk mengatasi stres akibat freezing (pembekuan) dan thawing (pencairan). Dengan demikian, disarankan untuk melakukan proses pencairan secepat mungkin. Saat menangani cryovial yang telah dibekukan dengan gliserol sebagai krioprotektan, pencairan dapat disederhanakan dengan mengencerkan sel kriopreservasi sepuluh kali langsung ke complete media yang dihangatkan sebelumnya, sehingga menghindari langkah sentrifugasi dan pencucian.
7. Penyelesaian Masalah Kultur Sel
Tabel 6. Kendala dan masalah yang umumnya terjadi pada kultur sel dan solusi yang disarankan
| Masalah | Kemungkinan Penyebab | Solusi yang Disarankan |
| Rendahnya jumlah sel viabel saat thawing (pencairan) | Penyimpanan tidak tepat | Mendapatkan stok sel baru yang disimpan dalam nitrogen cair yang belum dicairkan |
| Pencairan tidak tepat | Mencairkan sel cepat tetapi secara gradual, encerkan sel beku tetes demi tetes dengan media yang telah dihangatkan sebelumnya, tangani sel dengan perlahan, dan centrifuge dengan kecepatan rendah | |
| Paparan gliserol kecahaya | Jika agen gliserol digunakan dan terapar cahaya, produk sampingan akrolein mungkin beracun bagi sel | |
| Perlekatan sel ke vessel yang rendah setelah subkultur | Residu aktivitas enzim digestif | Mencuci sel secara menyeluruh dalam media yang sudah dihangatkan sebelum diganti |
| Digesti sel yang berlebihan | Kurangi waktu digesti dan blokir aktivitas enzimatik menggunakan inhibitor (FBS untuk Trypsin) | |
| Kontaminasi Mycoplasma | Lakukan tes Mycoplasma PCR rutin pada kultur | |
| Pertumbuhan sel lambat | Media pertumbuhan tidak tepat | Media pertumbuhan harus sesuai dengan persyaratan cell line dan (jika tersedia) mengandung serum yang telah difilter |
| Penipisan atau kerusakan komponen kultur sel esensial | Memastikan adanya faktor pemacu pertumbuhan dan gantilah komponen nonstabil seperti glutamin dengan GlutaMax | |
| Penyimpanan media dan suplemen tidak sesuai | Mengikuti petunjuk produsen dengan cermat | |
| Jumlah passaging terlalu tinggi | Laju proliferasi kultur sel dapat berhenti dengan subkultur terus-menerus, sel harus diganti dengan stok dengan passaging rendah | |
| Konfluensi terlalu rendah | Meningkatkan konsentrasi kepadatan penanaman awal | |
| Konfluensi terlalu tinggi | Sel harus dilakukan passage pada fase log (konfluensi ~ 80%) | |
| Kontaminasi Mycoplasma | Melakukan tes Mycoplasma PCR rutin pada kultur | |
| Perubahan pH medium secara cepat | Tekanan CO2 tidak sesuai | Menyesuaikan konsentrasi CO2 inkubator berdasarkan HCO3 − konsentrasi medium: 2,0g/L membutuhkan tingkat CO2 5%, sementara 3,7g/L pada CO2 10% |
| Rendahnya pertukaran gas | Mengendorkan tutup TC flask | |
| Buffer bikarbonat tidak cukup dalam media | Tambahkan HEPES (10–25mM) | |
| Kontaminasi bakteri | Mencermati kultur di bawah mikroskop cahaya | |
| Kematian sel | Rendahnya CO2 atau suhu berfluktuasi | Memantau tingkat CO2 dan suhu inkubator serta jangan meninggalkan sel di luar inkubator untuk waktu yang lama |
| Akumulasi toksin | Mengganti media kultur sel secara teratur | |
| Tekanan osmotik tidak sesuai | Meninjau osmolalitas media kultur sel dan efek potensial dari senyawa obat tambahan atau HEPES |
Referensi:
1. Aschner M, Costa L. 2019. Cell Culture Techniques. Humana Press. Springer.
2. Uphoff CC, Drexler HG. 2013. Basic Cell Culture Protocols. Humana Press. Springer.
3. Jalali M, Saldanha FYL, Jalali M. 2017. Basic Science Methods for Clinical Researchers. Academic Press.
Related articles:
1. Cell Line Merk Elabscience [Link]
2. Cell line untuk Penelitian SARS-CoV-2 dari Merk Elabscience [Link]
3. Memahami Konsep Dasar Media Kultur Sel Manusia dan Mamalia [Link]
4. Prinsip Laboratorium Kultur Sel Mamalia: Sistem Model In Vitro [Link]
5. Cara Memilih Inkubator Co₂ Yang Tepat Untuk Kultur Sel [Link]
6. 6 Alasan Memilih Kit Deteksi Apoptosis Annexin V Merk Elabscience® [Link]
7. 4 Alasan Memilih Kit Cell Proliferation and Toxicity Merk Elabscience® [Link]
8. 5 Alasan Memilih Kit TUNEL Assay Merk Elabscience® [Link]
9. ICellBox [Link]

