Mengenal Berbagai Prinsip Metode Polymerase Chain Reaction (PCR) dengan Introduksi Produk Multiplex RT-qPCR Kit dan Digital PCR Kit dari GenMark
Prosedur amplifikasi memiliki banyak keunggulan dibandingkan metode mikrobiologi standar dan prosedur hibridisasi asam nukleat. Sebagian besar metode amplifikasi dengan deteksi relatif cepat, serta sensitivitas dan spesifisitas tinggi. Beberapa teknik amplifikasi juga menyediakan data kuantitatif dan berguna untuk melacak perkembangan penyakit atau menyediakan jumlah salinan asam nukleat mikroba atau virus dalam sampel. Kelemahan dari prosedur amplifikasi lebih berfokus pada biaya, selain dari investasi alat, sumber daya manusia ahli dan laboratorium. Sensitivitas tinggi metode amplifikasi juga dapat menyebabkan overdiagnosis karena dapat mengidentifikasi asam nukleat residu patogen dalam jumlah kecil meskipun infeksi telah diatasi. Teknik PCR merupakan prosedur amplifikasi yang paling banyak digunakan oleh laboratorium klinis
A. Polymerase Chain Reaction (PCR)
PCR saat ini merupakan metode yang diminati di berbagai laboratorium klinis karena sederhana, sensitif dan akurat. PCR mampu memperbanyak satu salinan DNA target menjadi banyak produk asam nukleat selama 25-40 siklus reaksi. Setiap siklus PCR terdiri dari tiga langkah, yaitu denaturasi DNA target, annealing primer ke sekuens target, dan ekstensi primer. Pada langkah awal siklus, campuran reaksi PCR dipanaskan untuk memisahkan untaian DNA target. Reaksi kemudian didinginkan sehingga primer menempel pada untaian DNA target yang terpisah. Setelah proses tersebut, ekstensi primer terjadi yang mensintesis untaian DNA baru. DNA target diamplifikasi secara eksponensial selama beberapa siklus (25 hingga 40) dari tiga langkah reaksi ini.
Pada awal perkembangannya, metode PCR merupakan teknik yang memakan banyak tenaga karena tiga langkah di atas dilakukan secara manual. Namun pada 1986, instrumentasi thermal cycler pertama dikembangkan serta diikuti dengan penggunaan DNA polimerase termostabil pada 1988, menjadikan teknologi PCR semakin menjadi metode yang efisien dan mudah. Saat ini, PCR standar juga dikembangkan menjadi berbagai macam variasi teknik, misalnya reverse transcription PCR (RT-PCR), multiplex PCR, dan nested PCR. Metode ini memerlukan beberapa komponen utama antara lain, enzim DNA polimerase, buffer untuk polimerase, primer (oligonukleotida memulai sintesis untai DNA baru), ion magnesium (kofaktor DNA polimerase), empat deoksinukleotida trifosfat (dNTP-dA, dC, dG, dT), dan sumber template DNA (target).
B. Pencegahan Kontaminasi selama Prosedur PCR
Karena kesensitifan yang sangat tinggi dari PCR, kontaminasi amplikon pengujian sebelumnya atau asam nukleat dari lingkungan harus dieliminasi sedemikian mungkin. Penerapan biosafety cabinet, sterilisasi permukaan kerja dengan campuran alkohol dan bleach atau larutan setara, sterilitas diri dan alat laboratorium, serta penggunaan pipet tips tahan aerosol merupakan aspek yang harus selalu diperhatikan.
C. PCR Konvensional
Analisis amplikon PCR dapat dilakukan dengan berbagai prosedur. Analisis dengan elektroforesis gel agarosa dengan dye etidium bromida pada dekade lalu cukup populer dibandingkan saat ini. Disamping waktu elektroforesis gel agarosa relatif lama (1-2 jam untuk memisahkan produk PCR), proses ini juga menghasilkan limbah berbahaya (etidium bromida), memerlukan peralatan elektroforesis dan sistem pencitraan spesifik. Meskipun elektroforesis gel agarosa masih digunakan di laboratorium penelitian, hampir semua metode PCR di laboratorium klinis menggunakan Real-Time PCR.
D. Real-Time PCR
Pada 1990-an, real-time PCR dikembangkan untuk mendeteksi akumulasi amplikon secara langsung setelah setiap siklus PCR yang ditunjukkan dengan peningkatan sinyal fluoresensi saat reaksi berlangsung, tanpa melakukan elektroforesis. Real-time PCR juga jauh lebih cepat dibandingkan dengan PCR standar (konvensional). Metode PCR ini menggunakan dye reporter fluoresensi (dalam bentuk probe atau beacon berlabel, disebut fluorofor) dengan bantuan sinar ultraviolet untuk mengeksitasi reporter serta kamera yang dikendalikan oleh sistem komputer. Instrumen real-time PCR mampu mengukur peningkatan fluoresensi reporter ketika amplikon terakumulasi. Puncak fluoresensi didokumentasi oleh sistem komputer sebagai intensitas fluoresensi versus jumlah siklus PCR. Beberapa platform real-time PCR memiliki fitur analisis melting curve untuk memverifikasi kemurnian produk PCR dan menentukan adanya primer-dimer.
Fluoresensi diukur dengan memonitoring peningkatan fluoresensi secara langsung atau secara tidak langsung dengan proses yang disebut FRET (fluorescence resonance energy transfer). FRET adalah transfer energi dari dye donor ke dye akseptor. FRET juga terjadi antara dye fluoresensi dan quencher yang tetap menjaga sinar emisi tetap rendah sebelum dye fluoresensi dilepaskan dari quencher. Induksi FRET dilakukan dengan memastikan jarak dye fluoresensi dan quencher dalam jarak yang dekat (1-5 nukleotida).
Platform real-time PCR komersial saat ini biasanya menggunakan berbagai modalitas deteksi, seperti 5′ nuclease assay (TaqMan assay), dual-probe FRET, molecular beacons probe, primer Scorpion dan pewarna interkalasi (mis. SYBR Green). Beberapa platform tersebut juga menggunakan pertukaran udara cepat atau konduktivitas termal cepat pada vessel reaksi untuk mempercepat siklus termal, serta rasio permukaan:volume campuran reagen PCR yang tinggi.
1) 5′ nuclease assay (TaqMan)
5′ nuclease assay menggunakan aktivitas 5′ exonuclease dari Taq polimerase. Probe TaqMan merupakan oligonukleotida (18-22 basa) berlabel pada ujung 5′ dye reporter fluoresen dan ujung 3′ dye quencher. Fluoresensi dari reporter dijaga pada background rendah karena proksimitas quencher oleh FRET dimana fluorofor menyumbangkan energi ke quencher.
Probe TaqMan untuk PCR tertentu dirancang agar komplemen dengan wilayah internal amplikon PCR selama langkah annealing primer. Selama ekstensi primer, Taq DNA polimerase memperpanjang untai DNA komplementer dari primer menggunakan untai template dimana probe TaqMan mengalami annealing. Reporter kemudian dipotong oleh aktivitas 5′ nuclease, kemudian seluruh probe dipotong. Fluoresensi akan meningkat saat fluorofor menjauh dari quencher dengan skala linier dan lebih banyak produk PCR akan disintesis pada siklus PCR berikutnya.
Keuntungan Taqman assay antara lain, hanya produk PCR spesifik yang dideteksi, PCR konvensional serta reaksi hibridisasi dan pembelahan tidak mengganggu produk PCR. Salah satu kelemahannya yaitu probe spesifik harus dirancang dan/atau dibeli untuk target spesifik, probe berlabel fluoresensi relatif lebih mahal dibandingkan dengan oligonukleotida tanpa label, serta analisis melting curve tidak dapat dilakukan karena probe ini terhidrolisis selama proses amplifikasi.
2) Dual-probe FRET
Dual-oligonucleotide FRET (teknik FRET) merupakan metode menggunakan dua probe berlabel. Satu probe berlabel pada ujung 3′ dye fluoresen donor dan probe lainnya pada ujung 5′ dye fluoresen akseptor. Probe ini dirancang untuk annealing kepala-ke-ekor ke amplikon. Saat annealing terjadi, kedua dye fluoresen berdekatan dan FRET terjadi. Sinar diemisikan oleh platform akan mengeksitasi dye pada probe pertama, yang menghasilkan sinar fluoresensi dengan panjang gelombang lebih panjang. Energi yang dilepaskan oleh dye 3′ kemudian mengeksitasi dye fluoresensi pada probe kedua saling berdekatan. Dye tersebut kemudian akan memancarkan sinar fluoresensi pada panjang gelombang yang lebih panjang dari sebelumnya, dan kejadian ini akan diukur oleh platform. Intensitas emisi sinar fluoresensi berbanding lurus dengan jumlah produk PCR yang diamplifikasi selama reaksi.
Penting untuk diperhatikan bahwa, emisi hanya dapat terdeteksi ketika kedua probe annealing pada masing-masing sekuens komplementernya di amplikon PCR. Deteksi fluoresensi hanya terjadi setelah kedua probe terhibridisasi, sehingga pengukuran terjadi selama langkah annealing primer. Ketika suhu naik di langkah ekstensi primer, kedua probe dipindahkan oleh Taq DNA polimerase sehingga FRET terhenti karena probe saling berjauhan dan pengukuran tidak bisa dilakukan. Teknik ini mampu memberikan data analisis melting curve amplikon. Kelemahan metode FRET yaitu relatif membutuhkan biaya tinggi dan kemampuan desain probe yang berpengalaman.
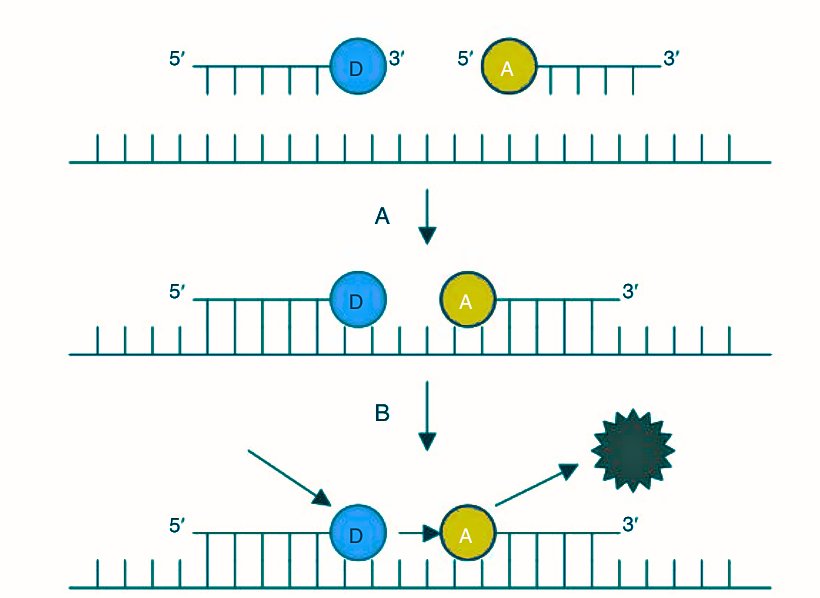
Gambar 1. Dual-oligonucleotide FRET. A, Dua probe berlabel annealing pada produk PCR saat terakumulasi. Satu probe dye fluoresens donor (D) ujung 3′ dan probe dye akseptor (A) ujung 5′. Dua probe tersebut annealing pada produk PCR dari kepala-ke-ekor. Sumber sinar dari platform PCR mengeksitasi dye fluoresens donor sehingga donor mentransfer energi ini ke akseptor. Dye akseptor tereksitasi dan memancarkan cahaya fluoresens, dibaca oleh platform. (Sumber: Steven D. Malhen, 2023)
3) Beacon Molekuler
Beacon molekuler menggunakan segmen DNA pendek dengan dye reporter berlabel fluoresens menempel pada ujung 5′ segmen DNA dan quencher pada ujung 3′. Bagian tengah beacon memiliki sekitar 20 basa yang komplemen dengan amplikon. Kedua ujung dirancang dengan basa DNA yang komplemen sehingga keduanya dapat berpasangan dan membentuk struktur hairpin dengan loop; fluoresensi dari reporter diredupkan (quenched) oleh FRET sementara beacon berada dalam hairpin karena dye dan quencher berdekatan.
Saat PCR berlangsung, denaturasi akan memisahkan template DNA, DNA produk PCR (jika ada) dan beacon. Penurunan suhu pada langkah annealing primer, DNA komplemen beacon annealing ke amplikon yang menjadikan hairpin terbuka dan menjauhkan quencher dan reporter, sehingga fluoresensi dari reporter dipancarkan. Beacon tanpa target komplementer akan membentuk hairpin dan tidak menghasilkan sinyal fluoresensi. Fluoresensi diamati berbanding lurus dengan amplikon yang terakumulasi. Berbeda dengan probe Taqman, beacon dapat didaur-ulang dan digunakan kembali sehingga dapat digunakan untuk analisis melting curve produk PCR.
4) Primer Scorpion
Primer Scorpion menggunakan satu oligonukleotida untuk primerisasi sekuens tertentu dan mendeteksi akumulasi produk PCR. Primer Scorpion menyerupai beacon molekuler karena bentuk primer Scorpion tak terhibridisasi yaitu hairpin loop. Primer Scorpion memiliki probe fluorofor dengan PCR blocker yang dihubungkan pada ujung 5′ dan quencher pada ujung 3′ dari struktur hairpin loop sehingga fluoresensi diredupkan saat target tidak ada. Saat fluorofor dan quencher terpisah maka akumulasi fluoresensi terjadi yang menunjukkan akumulasi amplikon.
5) SYBR Green
SYBR Green adalah dye fluoresensi yang berikatan dengan asam nukleat. Dye SYBR Green I mampu mengikat dsDNA (tidak mengikat untaian ssDNA) secara nonspesifik dimana sebagian besar produk amplikon berupa dsDNA, sehingga SYBR Green I sering digunakan dalam penerapan ini. Peningkatan fluoresensi akan terjadi ketika produk PCR terakumulasi. Beberapa molekul dye akan mulai mengikat DNA selama annealing primer sehingga fluoresensi background rendah, serta secara cepat mengikat dsDNA selama ekstensi primer, menjadikan deteksi oleh platform dapat terjadi setelah setiap siklus PCR.
SYBR Green relatif lebih murah dibandingkan penggunaan probe berlabel dan juga dapat menganalisis melting curve produk. Akan tetapi, dye tersebut mengikat produk nonspesifik dan juga mampu mengikat primer-dimer, sehingga tidak dapat membedakan berbagai produk PCR. Perlu diperhatikan bahwa analisis melting curve harus dilakukan setelah deteksi SYBR Green digunakan untuk menentukan apakah primer-dimer atau produk PCR nonspesifik telah terbentuk. Suhu melting curve untuk primer-dimer dan produk nonspesifik akan berbeda dengan suhu untuk produk PCR amplifikasi..
6) Reverse transcription PCR (RT-PCR)
RT-PCR menggunakan enzim reverse transcriptase yang merupakan DNA polimerase bergantung-RNA untuk mensintesis untai DNA komplementer (DNA komplementer atau cDNA) dari template RNA. Hasil cDNA yang terbentuk kemudian digunakan sebagai template dalam PCR menggunakan DNA polimerase standar.
RT-PCR sering digunakan di laboratorium mikrobiologi klinis untuk mendeteksi virus RNA dalam spesimen klinis. RT-PCR dapat digunakan juga untuk mengukur jumlah virus dalam spesimen klinis. Aplikasi RT-PCR lainnya meliputi analisis kuantitatif ekspresi gen, deteksi gen manusia pada penyakit, serta deteksi kanker.
7) Multiplex PCR
Multiplex PCR digunakan untuk mendeteksi dua target berbeda atau lebih secara bersamaan dalam satu sampel reaksi PCR. Dalam prosedur ini, beberapa set primer untuk target berbeda ditambahkan sekaligus dalam reaksi PCR yang menargetkan template berbeda atau wilayah berbeda dari template sama. Ukuran amplikon dari gen berbeda harus memiliki panjang berbeda (panjang bp) sehingga pita berbeda dapat divisualisasikan melalui elektroforesis gel maupun data divisualisasikan pada platform real-time PCR. Sebagai alternatif, amplikon berbeda dapat dibedakan dan divisualisasikan menggunakan primer yang dikonjugasikan dengan dye fluoresensi berbeda.
Multiplex PCR dibagi menjadi dua jenis, reaksi single-template PCR dan multiple-template PCR. Reaksi single-template PCR menggunakan satu templat dan beberapa pasang primer, sedangkan reaksi multiple-template PCR menggunakan beberapa template dan primer dalam tabung sama. Multiplex PCR paling sering digunakan untuk mengidentifikasi spesies berbeda dari sampel kompleks (misalnya, air yang terkontaminasi, makanan, atau spesimen klinis).
8) Digital PCR
Metode terbaru ini merupakan teknik real-time PCR yang dapat diukur dan menerjemahkan data amplifikasi eksponensial menjadi sinyal digital. Digital PCR mempartisi sampel asam nukleat menjadi banyak PCR individual. Dalam pengujian Digital PCR terkini, disebut Droplet Digital PCR, template dan reagen PCR didispersi dalam ribuan droplet kecil. Setiap droplet hanya mengandung satu molekul target awal atau tidak sama sekali, serta reaksi PCR akan berlangsung padai setiap droplet. Sebagian besar droplet nantinya tidak mengandung template, sedangkan sisanya mengandung asam nukleat target individual. Setelah beberapa siklus amplifikasi PCR, sampel melalui proses screening fluoresensi dan ditandai sebagai 0 atau 1. Fraksi droplet dengan emisi fluoresensi selanjutnya dicatat. Kuantitas absolut asam nukleat kemudian dapat ditentukan berdasarkan jumlah sinyal reaksi positif. Reaksi dengan asam nukleat target berikutnya dikonversi menjadi sinyal digital positif, sedangkan reaksi tanpa asam nukleat target dikonversi menjadi sinyal digital negatif. Digital PCR saat ini berkembang pesat dan telah digunakan dalam berbagai aplikasi, termasuk screening genetik, onkologi dan pendeteksian asam nukleat mikroba dalam jumlah rendah.
E. Lini Produk Real-Time PCR Kit dan Digital PCR Kit dari GenMark
GenMark geneMAP™️ menawarkan berbagai produk kit Real-Time PCR dalam ranah kesehatan menghadapi berbagai masalah kesehatan terbaru dan peningkatan keragaman instrumen Real-Time PCR Produk kit geneMAP™️ menghadirkan prosedur yang inovatif dan fleksibel, serta memenuhi kebutuhan laboratorium klinis berdasarkan prevalensi dan pasar terkini.
Produk kit geneMAP™️ mampu menawarkan produk diagnostik berkualitas tinggi, kuantitatif, akurasi dan presisi tinggi, serta reliabel di domain onkologi molekuler, genetika molekuler dan mikrobiologi molekuler:
- Molecular Oncology qPCR kit dari geneMAP™️ (Multiplex) menawarkan bermacam produk inovatif, kuantitatif, fleksibel dan multiplex untuk diagnosis, prognosis dan manajemen MRD terlengkap untuk cancer darah.
- Pathology Oncology qPCR kit dari geneMAP™️ (Multiplex) menawarkan produk inovatif, kuantitatif, praktis, akurat dan komprehensif dengan analisis yang mudah, dikembangkan khusus untuk solid tumor.
- Molecular Genetic dan Microbiology qPCR kit dari geneMAP™️ (Multiplex) menawarkan produk dalam pemeriksaan kesehatan masyarakat dan infeksi dengan mengutamakan efisiensi dan akurasi menjadikan kit berikut ideal untuk laboratorium dengan beban kerja berat dan siklus intensif.
- geneMAP™️ Molecular Hematology dPCR Kit dan Community Screening dPCR Kit menyediakan produk digital PCR yang telah tervalidasi dan inovatif sebagai alternatif metode yang paling akurat dengan sensitivitas tertinggi.
F. Referensi
- Angela Lima, Lu´cia G. V. Sousa, and Nuno Cerca. 2023. Accurate Absolute Quantification of Bacterial Populations in Mixed Cultures by qPCR. PCR Methods and Protocols. 2nd Edition. Springer.
- Patricia M. Tille. 2022. Bailey & Scott’s Diagnostic Microbiology. 15th Edition. Elsevier.
- Steven D. Mahlen, Vijay Parashar. and Donald C. Lehman. 2023. Applications of molecular diagnostics. Textbook of Diagnostic Microbiology. 7th Edition. Elsevier.
- GenMark Saglik Urunleri. https://www.genmark.com.tr/

