Pelatihan Operasi dan Troubleshooting TUNEL In Situ Apoptosis Kit (Red, E-CK-A322) di Laboratorium Elabscience, Wuhan, Cina

I. Pengertian Apoptosis
Apoptosis adalah proses kematian sel terprogram (programmed cell death, PCD) yang diregulasi oleh gen. Apoptosis merupakan suatu proses normal dalam tubuh yang telah berlangsung sangat lama selama sejarah evolusi serta perkembangan organisme yang tidak menimbulkan respon inflamasi dengan tujuan memberikan manfaat bagi kelangsungan hidup organisme tingkat tinggi seperti hewan.
Elabscience® One-step TUNEL In Situ Apoptosis Kit menggunakan metode yang sangat sensitif, cepat, dan sederhana dalam mendeteksi apoptosis sel serta sesuai untuk deteksi apoptosis in situ pada sampel jaringan (parafin atau beku) dan sel (slide atau smear). Hasil yang diperoleh dapat diamati langsung melalui mikroskop fluoresensi atau konfokal.
Saat sel mengalami apoptosis, endonuklease DNA spesifik akan diaktifkan dan kemudian memotong DNA genom di antara nukleosom. DNA sel apoptotik dipotong-potong menjadi multimer dengan ukuran fragmen 180~200 bp dimana sesuai dengan ukuran oligonukleosom. Pada gel agarosa, DNA sel apoptotik biasanya bermigrasi sebagai ladder 180~200 bp. Gugus terminal 3′-OH yang terekspos dari DNA rusak selanjutnya dapat dikatalisis oleh enzim TdT (Terminal Deoxynucleotidyl Transferase) dengan fluorokrom berlabel dUTP,yang dapat dideteksi dengan mikroskop fluoresensi.
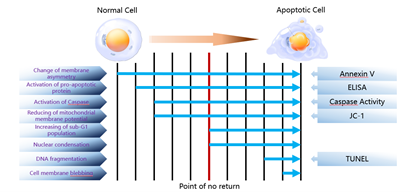
Gambar 1. Proses apoptosis sel (Sumber: Elabscience)
Kegiatan ini dilakukan di bawah pengawasan Lim dari Departemen QC/QA dan Richard dari Departemen Technical Support Elabscience yang mendampingi proses pengujian TUNEL Assay.
| Jenis kematian sel | Faktor | Karakteristik | Eksekutor | Efek |
| Apoptosis | Proses normal yang diregulasi secara baik |
|
Caspase | Terjadi secara individual dalam sel tunggal |
| Pyroptosis |
|
|
Gasdermin-D | Efek inflamasi |
| Ferroptosis | Kelebihan zat besi |
|
Akumulasi LPO | Respon imun |
| Nekrosis |
|
|
(Tidak ada) | Inflamasi akut |
II. Prinsip TUNEL (TdT-mediated dUTP Nick-End Labeling)
- DNA didegradasi menjadi potongan-potongan kecil dengan ukuran 180-200 bp dengan gugus terminal 3’-OH;
- dUTP kemudian dihubungkan ke gugus terminal 3’-OH oleh enzim TdT
- dUTP dikonjugasikan dengan dye fluoresensi agar dapat dideteksi;
- Sel-sel tahap akhir apoptosis dapat dideteksi dengan diberi label dengan dUTP;
- (In situ) pelabelan nukleus dengan dye fluoresensi spesifik nukleus (misalnya DAPI) untuk mengetahui lokasi.
| Dnase I | Enzim TdT | Agen Pelabelan | Tujuan | |
| Positif | ✔ | ✔ | ✔ | Validasi reagen dan operasi berfungsi atau tidak |
| Negatif | ✘ | ✘ | ✔ | Mengeluarkan pewarnaan non-spesifik dan baseline untuk voltase/parameter |
| Sampel | ✘ | ✔ | ✔ | Uji sampel |
III. Variasi Sampel untuk TUNEL Assay
1. In Situ Assay
Sampel jaringan:
-Paraffin section
-Frozen section
-Sampel sel:Cell smear/crawling
2. Flow Cytometry Assay
Suspension cell:
– Sulit difiksasi
– Mudah rontok
Adherent cell:
– Mengambang selama apoptosis
IV. Jenis Sampel Sel
Lingkungan Kultivasi
- Konsentrasi serum < 20%
- Operasi steril
- Perubahan medium: setengah dosis
- Rasio generasi
Densitas Vaksinasi
- Tingkat pertumbuhan
- Periode pemberian perlakuan
- Efikasi yang diharapkan
- 80% dari maksimum
Kondisi Perlakuan
- Metode sterilisasi
- Toksisitas pelarut
- Kelarutan
- Gangguan fluoresensi
Catatan:
Sel yang digunakan sebaiknya pada fase logaritmik dengan pertumbuhan stabil;
Respon intervensi dapat dikaitkan dengan kondisi sel.
V. Jenis Sampel Jaringan
Paraffin Section
- Lebih jelas & lebih tipis
- Lebih baik untuk preservasi jangka panjang
- Fiksasi baik: perendaman/perfusi
- Dehidrasi harus penuh dan baik
- Mempertahankan kelembaban
- Blok parafin didinginkan sebelumnya
Frozen Section
- Preparasi Lebih Mudah & Cepat
- Kerusakan pada protein antigen lebih sedikit
- Pendinginan cepat
- Pembekuan seragam ➙ ukuran ketebalan
- Tidak terlalu sulit untuk dipotong
- Berhati-hati aktivitas
VI.Preparasi Bahan dan Sampel
Paraffin section
- Dewaxing secara menyeluruh
- Perpanjang waktu dewaxing hingga 30 menit pada suhu rendah
- Pencucian dengan alkohol dengan konsentrasi gradien (100%, 90%, 80%, 70%) dan hindari sampel menjadi kering selama semua proses
Frozen Section
- Hangatkan kembali sampel beku dari suhu -80 ℃ selama 3-5 menit pada suhu ruangan
- Fiksasi selama 30 menit dengan 4% paraformaldehyde (PFA) pada suhu ruangan
Cell Crawling
- Buang cairan supernatan setelah dicuci dengan PBS dan hindari sampel menjadi kering
- Perendaman dalam PFA 4% untuk fiksasi selama 15-20 menit dalam suhu kamar atau 1-2 jam dalam suhu 4 ℃.
Bahan lain di luar kit E-CK-A322:
- Xylene dua botol
- Ethanol: 100% (dua botol), 90%, 80%, 70%
- 2% Triton X-100 (E-IR-R122)
- 1x PBS (E-BC-R187)
- ddH2O
- Kertas saring
- Mounting solution with anti-fluorescence quencher (E-IR-R119)
- Fluorescence microscope / confocal microscope
VII. Preparasi Sampel Permeabilisasi dan Reagen
- Permeabilisasi
- Proteinase K untuk sampel jaringan parafin dan beku, 0,2% Triton X-100 untuk sampel sel. Siapkan reagen hanya sebelum akan digunakan.
- Kontrol Positif
- Hanya sampel positif diberi perlakuan dengan DNase I;
- Perlakukan sampel negatif dan sampel dengan buffer diluent DNase I.
- Labeling
- Jangan menghilangkan buffer equilibration secara keseluruhan
- Siapkan larutan pelabelan hanya sebelum digunakan;
- Jangan mewarnai terlalu lama;
- Hindari gelembung saat mounting.
Catatan:
- Shading Light
- Reagen dan Operasi
1. Langkah Preparasi Slide Jaringan (Paraffin Section)
Langkah Kerja Jaringan Parafin:
- Lakukan deparafinisasi dan hidrasi jaringan slide parafin dengan metode konvensional. Celupkan jaringan slide ke dalam xylene dua kali selama 15 atau 20 menit. Hidrasi jaringan parafin dengan etanol dengan persentase yang berbeda: etanol 100% dua kali selama 15 menit, 90% satu kali selama 10 menit, 80% satu kali selama 10 menit, dan 70% satu kali selama 10 menit.Catatan: Jika suhu ruangan lebih rendah dari 20°C, waktu deparafinasi dalam xylene dapat diperpanjang hingga 20 menit karena suhu rendah dapat mempengaruhi efek deparafinisasi xylene.
- Cuci slide dengan PBS atau air sebanyak 3 kali selama 5 menit masing-masing.

- Seraplah kelembaban di sekitar jaringan dengan kertas saring. Tambahkan 100 μL larutan kerja 1×Proteinase K ke setiap sampel dan inkubasi pada 37°C selama 20 menit. Catatan: Waktu inkubasi untuk sampel dari jaringan atau spesies yang berbeda mungkin berbeda. Sebaiknya lakukan percobaan pendahuluan untuk memastikan waktu inkubasi.

- Cuci slide dengan PBS atau air sebanyak 3 kali selama 5 menit masing-masing.

| Kelompok | Pemilihan sampel | Karakteristik | Tujuan |
| Kontrol positif | Pilih slide jaringan tertentu dari kelompok perlakuan eksperimen | Beri perlakuan DNase I untuk memotongan DNA untuk menghasilkan ujung 3′ -OH yang terekspos: sebagai sampel positif | Verifikasi efektivitas proses operasi/pengerjaan dan reagen eksperimen |
| Kontrol negatif | Pilih slide jaringan dari kelompok perlakuan eksperimen | (Opsional) melabeli larutan kerja yang tanpa mengandung Enzim TdT | Mengesampingkan autofluoresensi sampel serta staining non-spesifik pada sampel dan reagen pewarnaan; Penyesuaian intensitas paparan |
| Sampel Uji | Preparat jaringan sampel yang akan dideteksi | Penting untuk menginkubasi larutan kerja yang dilabeli guna menjaga konsistensi kondisi deteksi eksperimental | Sumber data eksperimental |
Kontrol positif dan negatif sangat disarankan untuk dilakukan demi menunjukkan kinerja personel laboratorium, kinerja reagen, serta objektivitas dan keakuratan TUNEL. Disarankan untuk melakukan uji kontrol positif dan negatif pada setiap percobaan.
Catatan: Persiapan kontrol negatif dan positif dapat dilakukan secara bersamaan.
Langkah Preparasi Kontrol Positif
- Tambahkan 100 μL 1×DNase I Buffer ke setiap slide jaringan, dan inkubasi pada suhu RT selama 5 menit.
- Serap cairan di sekitar area sampel jaringan dengan hati-hati menggunakan kertas penyerap.
- Tambahkan 100 μL larutan kerja DNase I (200 U/mL) ke setiap slide jaringan, dan inkubasi pada suhu 37°C selama 10~30 menit.
- Cuci slide jaringan 3 kali dengan membasahi jaringan dengan PBS selama 5 menit setiap kali.
Langkah Preparasi Kontrol Negatif
- Tambahkan 100 μL 1 × DNase I Buffer ke setiap slide, dan inkubasi pada suhu RT selama 5 menit.
- Inkubasi sampel jaringan untuk kontrol negatif dengan DNase I Buffer pada suhu 37°C selama 10~30 menit.
- Cuci slide jaringan 3 kali dengan membasahi jaringan dengan PBS selama 5 menit setiap kali.
Langkah Preparasi Kelompok Eksperimen
- Setelah menyelesaikan langkah penetrasi, sampel eksperimen ditempatkan dalam PBS dan menunggu hingga Kontrol Positif dan Kontrol Negatif diberi label dan diwarnai bersamaan seperti yang dijelaskan diatas.
2. Langkah Persiapan Labeling Working Solution
Siapkan Labeling Working Solution sesuai dengan jumlah sampel. Tabel di bawah ini menunjukkan penggunaan reagen untuk setiap sampel jaringan. Selalu siapkan larutan baru dan segar sebelum digunakan untuk setiap pengujian.
| Komponen | Kontrol Positif / Eksperimen (per sampel) | Kontrol Negatif
(per sampel) |
| TdT Equilibration Buffer | 35 μL | 40 μL |
| Labeling Solution | 10 μL | 10 μL |
| TdT Enzyme | 5 μL | 0 μL |
Catatan:
- Bawa dan taruh TdT Equilibration Buffer pada suhu ruangan hingga cairan reagen benar-benar larut dan campurkan hingga merata sebelum digunakan. Jangan khawatir tentang TdT Equilibration Buffer yang mengkristal setelah mencair karena merupakan fenomena normal.
- Sebelum menggunakan Labelling Solution, larutkan reagen di atas es dan gunakan setelah tercampur rata.
- Enzim TdT sensitif terhadap suhu, jadi sebaiknya disimpan pada suhu -20°C. Keluarkan enzim TdT sebelum digunakan dan simpan segera setelah digunakan.
- Pipet secara perlahan-lahan Labeling Working Solution untuk mencampur enzim TdT. Jangan mencampur atau mengaduk dengan vortex mixer.
VIII. Pelabelan
- Tambahkan 100 μL TdT Equilibration Buffer ke setiap sampel jaringan dan inkubasi pada suhu 37°C selama 10~30 menit.
- Serap cairan di sekitar area sampel jaringan dengan hati-hati menggunakan kertas penyerap. Jangan biarkan sampel mengering.
- Tambahkan 50 μL Labeling Working Solution ke setiap sampel jaringan, dan inkubasi pada suhu 37°C selama 60 menit di ruangan yang gelap dan lembap. Catatan: Jika intensitas sinyal rendah, waktu inkubasi untuk reaksi pelabelan DNA dapat diperpanjang. Waktu pelabelan hingga 4 jam pada suhu 37°C mungkin diperlukan untuk beberapa kasus dan alasan.
- Cuci slide jaringan 3 kali dengan membasahi jaringan dengan PBS selama 5 menit setiap kali.
- Serap cairan di sekitar area sampel jaringan dengan hati-hati menggunakan kertas penyerap.
- Tambahkan DAPI Working Solution dan inkubasi pada suhu RT selama 5 menit tanpa cahaya.
- Cuci slide jaringan 4 kali dengan membasahi jaringan dengan PBS selama 5 menit setiap kali.
- Serap cairan di sekitar area sampel dengan hati-hati menggunakan kertas penyerap.
- Tambahkan Anti-Fluorescence Quenching Agent and Mounting Reagent (yang sudah disiapkan sendiri) untuk menutup slide.

IX. Dokumentasi Foto (Gambar)
- Ambil foto setelah pelabelan secepatnya
- Sesuaikan penguatan & pencahayaan: tidak boleh ada sinyal yang tampak pada kontrol negatif dan sel terpisah pada kontrol positif.
- Gunakan kondisi/parameter yang sama untuk setiap sampel (rekomendasi, lakukan pengecekan pada kontrol negatif dan kemudian kontrol positif)
- Meminimalkan waktu pencahayaan sebanyak mungkin untuk menghindari quenching.
X. Analisa Hasil dan Troubleshooting
- Sampel dapat langsung dianalisis di bawah mikroskop fluoresensi dengan filter yang sesuai.
- Harap amati hasilnya sesegera mungkin, jika tidak, simpan slide pada suhu 4°C dan lindungi dari cahaya.
- Jika menggunakan kontrol, sesuaikan parameter, terutama Waktu Pencahayaan, untuk setiap filter yang digunakan.
Hasil Kontrol Negatif
| DAPI | Elab Fluor® 594 | Merged | |
| Neg 1 | 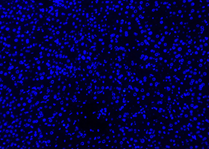 |
 |
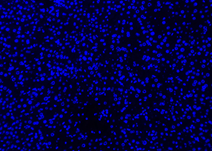 |
| Neg 2 | 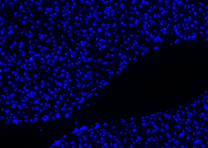 |
 |
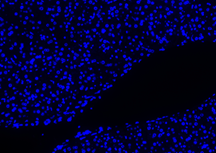 |
| 4x (Perbesaran) | 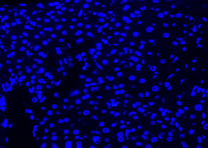 |
 |
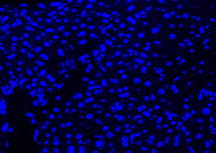 |
Kontrol Positif
| DAPI | Elab Fluor® 594 | Merged | |
| Pos 1 | 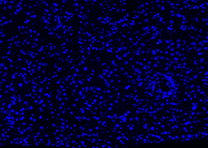 |
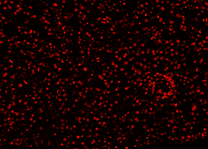 |
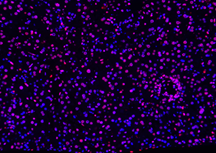 |
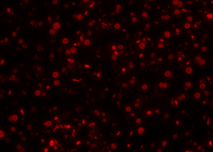
| Pos 2 | 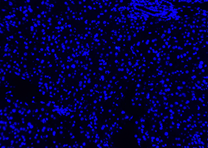 |
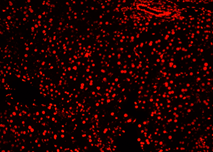 |
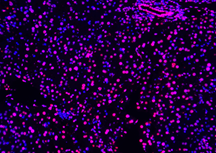 |
| 4x (Perbesaran) | 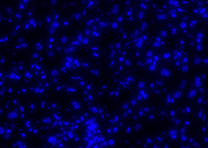 |
 |
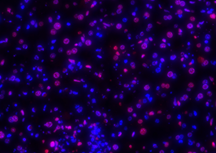 |
Sample (Mencit Normal)
| DAPI | Elab Fluor® 594 | Merged | |
| Sample | 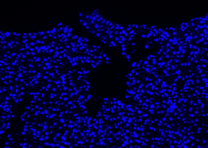 |
 |
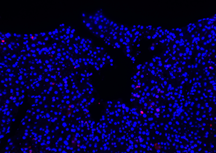 |
| 4x (Perbesaran) | 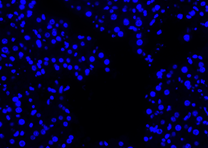 |
 |
 |
Pemecahan Masalah dan Hasil Kesalahan
- Positif Menyeluruh
- Salah operasi dan memerlukan sampel uji sebagai kontrol positif (penambahan Dnase I ke semua sampel eksperimen)
- Positif palsu karena adanya paparan berlebih
- Sampel spesifik dengan aktivitas proliferasi dan metabolisme yang cukup tinggi
- Fiksasi tidak sempurna
- Paparan suhu tinggi (terutama terjadi pada IF)
- Positif Lemah (sedikit atau tidak ada sinyal)
- Inaktivasi enzim TdT (penyimpanan/campuran/buffer)
- Kegagalan/kesalahan preparasi larutan pelabelan
- Sampel ternyata non-apoptosis atau tidak cukup adanya sel mengalami apoptosis
- Pemadaman/quenching fluoresensi
- Reagen fiksasi tidak sesuai dengan jenis sampel
- Permeabilisasi tidak sempurna
- Background Noise Kuat
- Terlalu terwarnai
- Pengeringan yang tidak sempurna
- Pencucian yang tidak sempurna
- Sampel menjadi kering saat pengoperasian
- Terlalu lama terpapar
- Pewarnaan Nonspesifik
- Autofluoresensi (misalnya eritrosit yang tersisa)
- Pengotor pada sampel
- Equilibrium tidak mencukupi
- Pewarnaan tidak seragam
- Dewaxing yang tidak sempurna
- Reagen permeabilisasi tidak sesuai
XI. Metode HRP-DAB Assay
- Blocking: Menghilangkan gangguan dari katalase endogen
- Sel: Fiksasi → Blocking→ Permeabilisasi
- Jaringan: Fiksasi → Permeabilisasi → Blocking