Webinar-Workshop Cell Culture: “The Significance of Employing Reduced and Serum-Free Media for Stem Cells and Stable Cell Lines in Research”

Gambar 1. Peserta dan Panitia Kegiatan Workshop
I. Pendahuluan
Pada tanggal 13 hingga 15 Januari 2026, PT Indogen Intertama dan Nacalai Tesque Inc., bekerjasama dengan Departemen Biokimia dan Biologi Molekuler Fakultas Kedokteran Universitas Indonesia menyelenggarakan kegiatan Webinar dan Workshop Cell Culture di FKUI, Salemba, Jakarta. Kegiatan ini diikuti oleh civitas akademika, klinisi dan juga sektor swasta industri. Serangkaian kegiatan ini diawali dengan kegiatan webinar pada hari pertama yang dipandu oleh dr. Ariel Pradipta, M.Res., Ph.D. Berikut adalah pemateri dan materi yang disampaikan saat webinar.
| Nama | Materi |
| Prof. Dr.rer.physiol. dr. Septelia Inawati Wanandi
(Biochemistry and Molecular Biology, Faculty of Medicine, University of Indonesia) |
Cell Culture Fundamentals: An Introduction and Practical Tips |
| Ratih Rinendyaputri, S.K.H., M.Biomed
(Center for Biomedical Research, National Research and Innovation Agency – BRIN) |
A Reduced-Serum Approach to hMSC Culture: Minimizing Variability and Improving Experimental Reliability |
| Kenji Yoshimochi, Ph.D. & Mana Shimotsuma, M.Pharm
(Nacalai Tesque, Inc. Kyoto, Japan) |
Reduced-serum DMEM/F12 Medium for Enhanced Cell Culture Applications and Basal Culture Medium Provided by Nacalai Tesque, Inc. For Standard Cell Growth |
Setelah webinar, kemudian dilanjutkan dengan kegiatan workshop yang terdiri dari Thawing of cells (cell recovery), Preparation of media culture, Seeding of cells, Counting of cells, Harvesting of cells, Cryopreservation.
II. Workshop Cell Culture
A. Thawing Cell Line
Proses thawing cell line merupakan tahap penting dalam kultur sel yang bertujuan untuk mengembalikan sel yang telah di kriopreservasi ke kondisi fisiologis normal agar dapat tumbuh dan berfungsi kembali. Thawing yang tidak tepat dapat menyebabkan penurunan viabilitas sel akibat pembentukan ulang kristal es dan stres osmotik. Oleh karena itu, pencairan sel umumnya dilakukan secara cepat menggunakan water bath bersuhu sekitar 37 °C. Kecepatan thawing yang tinggi membantu meminimalkan kerusakan membran sel yang disebabkan oleh rekristalisasi es. Tahap ini menjadi penentu utama keberhasilan kultur sel lanjutan setelah penyimpanan jangka panjang.
Secara umum, tahapan thawing cell line dapat divisualisasikan melalui Gambar 2. Proses dimulai dengan pengambilan cryovial dari nitrogen cair, kemudian dicairkan secara cepat di water bath bersuhu 37 °C hingga sel hampir seluruhnya mencair. Setelah itu, bagian luar vial didesinfeksi dan suspensi sel dipindahkan ke media kultur hangat untuk mengencerkan cryoprotectant seperti DMSO. Selanjutnya, sel kemudian disentrifugasi ringan untuk membuang DMSO sebelum ditanam ke flask kultur dan diinkubasi pada CO2 incubator dengan persentase CO2 sebanyak 5% dan suhu 37 °C.
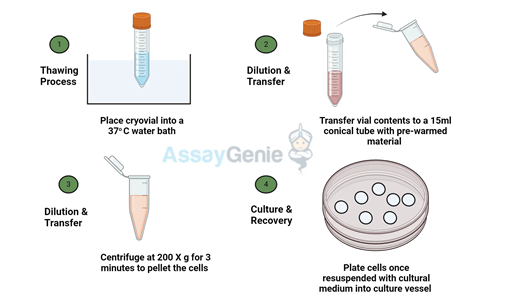
Gambar 2. Prosedur Kerja Secara Umum untuk Thawing Cell Line
Selain kecepatan thawing, faktor penting lain adalah pengurangan paparan cryoprotectant seperti dimetil sulfoksida (DMSO) yang bersifat toksik pada suhu ruang. Setelah sel mencair, suspensi sel harus segera diencerkan dengan medium kultur hangat untuk menurunkan konsentrasi DMSO. Viabilitas sel pasca-thawing dipengaruhi oleh jenis sel, komposisi medium, serta kondisi pembekuan dan pencairan sebelumnya. Sel yang sensitif seperti sel punca atau sel primer memerlukan penanganan thawing yang lebih hati-hati dibandingkan cell line immortal. Dengan protokol thawing yang optimal, sel dapat kembali berproliferasi dan mempertahankan karakteristik biologisnya.
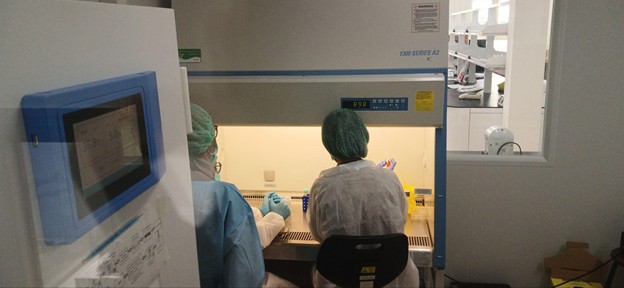
Gambar 3. Kegiatan Thawing Cell Line
Cell line yang digunakan dalam workshop ini adalah Human Lung Cancer Cells A549 dan Human Glioblastoma Cells U-87 MG. A549 merupakan sel yang berasal dari jaringan adenokarsinoma paru manusia dan memiliki karakteristik menyerupai sel epitel alveolar tipe II. Cell line ini banyak digunakan sebagai model in vitro untuk penelitian kanker paru, toksikologi, serta studi fisiologi dan patologi paru karena stabilitas dan kemudahan kultur selnya. Sedangkan U-87 MG adalah sel yang berasal dari tumor glioblastoma multiforme manusia dan banyak digunakan sebagai model penelitian kanker otak. Sel ini digunakan untuk mempelajari mekanisme pertumbuhan tumor, invasi, serta respons terhadap terapi antikanker dalam bidang neuro-onkologi.
B. Persiapan Medium Kultur
Medium kultur yang umumnya digunakan dalam penelitian adalah Dulbecco’s Modified Eagle Medium (DMEM). Penggunaannya yang umum ini karena DMEM mampu menyediakan nutrien dasar yang diperlukan untuk pertumbuhan dan proliferasi sel. Medium ini merupakan modifikasi dari Eagle’s Minimal Essential Medium (MEM) dengan peningkatan konsentrasi glukosa, asam amino, vitamin, dan garam anorganik untuk memenuhi kebutuhan metabolik sel yang cepat membelah. Glukosa tinggi dalam DMEM memberikan sumber energi utama bagi sel untuk sintesis ATP, metabolisme, dan proliferasi. Selain itu, DMEM mendukung keseimbangan pH dan osmolalitas yang stabil ketika digunakan dalam inkubator dengan kondisi CO₂ (biasanya 5%), sehingga lingkungan sel tetap optimal.
DMEM biasanya digunakan bersama dengan Fetal Bovine Serum (FBS) atau faktor pertumbuhan lain karena medium ini sendiri tidak mengandung protein atau hormon yang esensial untuk adhesi, diferensiasi, dan viabilitas sel. Akan tetapi, penggunaan FBS menghadirkan beberapa kekhawatiran ilmiah dan praktis terkait penggunaannya. Salah satu isu utama adalah variabilitas antar batch yang tinggi, hal ini karena komposisi FBS tidak sepenuhnya terdefinisi dan dapat berbeda antar lot sehingga berdampak pada reprodusibilitas eksperimen dan membutuhkan uji kualitas yang intensif untuk setiap batch baru yang digunakan.
Selain itu, FBS dapat membawa risiko kontaminasi mikroba atau virus jika tidak diproses dan disaring secara ketat sehingga memerlukan kontrol kualitas tambahan dalam kultur sel. Dengan adanya faktor‑faktor tersebut—ketidakpastian komposisi serum, variasi biologis antar lot, risiko kontaminasi, dan kekhawatiran etika—banyak peneliti semakin tertarik pada alternatif medium serum‑rendah yang lebih konsisten dan terdefinisi.
Untuk mengatasi kekhawatiran terkait penggunaan FBS, Nacalai Tesque menghadirkan medium Reduced Serum DMEM/Ham’s F-12 (RF12) yang memungkinkan kultur sel dengan serum rendah. Medium ini tetap menyediakan nutrien, vitamin, dan faktor pertumbuhan yang cukup untuk mendukung viabilitas, proliferasi, dan morfologi sel, sekaligus mengurangi variasi eksperimen akibat serum. Pendekatan ini membantu peneliti memperoleh data lebih reproducible dan menurunkan biaya serta mengurangi isu etika terkait serum.
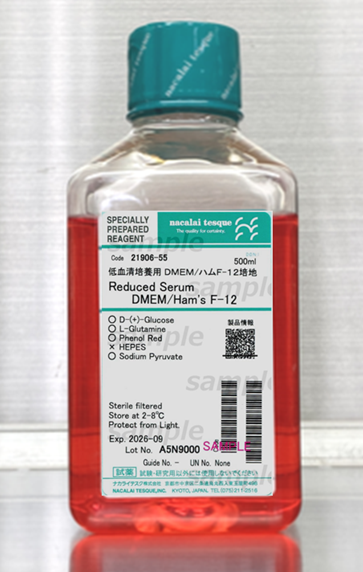
Gambar 4. Medium Reduced Serum DMEM/Ham’s F-12 brand Nacalai Tesque
Dalam workshop ini, kami ingin melihat bagaimana pertumbuhan dan perkembangan sel yang ditumbuhkan dalam komposisi medium yang berbeda. Berikut adalah rinciannya.
| Nama Medium | Komposisi Medium |
| Medium A | DMEM High Glucose 89%, FBS 10%, Antibiotik‑Antimikotik 1% |
| Medium B | Reduced Serum DMEM/Ham’s F-12 (RF12) 97%, FBS 2%, Antibiotik‑Antimikotik 1% |
Selain penggunaan DMEM, RF12, dan FBS, digunakan pula antibiotik‑antimikotik yang berfungsi untuk mencegah kontaminasi mikroba selama proses kultur, menjaga integritas eksperimen. Kedua medium di atas dipilih untuk menilai perbedaan respon sel terhadap kondisi serum tinggi versus serum rendah.


Gambar 5. Peserta masing-masing membuat medium kultur A dan B sebanyak 10mL
C. Penyemaian Sel (Seeding of Cells)
Seeding of cells adalah langkah awal dalam kultur sel yang menentukan jumlah sel awal yang ditempatkan di permukaan atau volume medium kultur sehingga mempengaruhi bagaimana sel tersebut akan menempel, berinteraksi, dan mulai proliferasi dalam fase awal kultur in vitro. Kondisi awal ini tidak hanya menentukan seberapa cepat sel mencapai konfluensi yang diinginkan tetapi juga mempengaruhi profil proliferasi dan ekspresi gen sel.
Densitas seeding awal merupakan variabel kritis yang secara langsung mempengaruhi ketersediaan nutrien, viabilitas, dan metabolisme sel dalam kultur terapan. Di mana densitas yang terlalu tinggi dapat menyebabkan kematian sel dan kerusakan matriks ekstraseluler akibat keterbatasan difusi nutrien. Hal ini menunjukkan bahwa seeding sel memengaruhi kinerja kultur dalam jangka panjang.
Dalam workshop kali ini, para peserta melakukan penyemaian sel secara berpasangan. Dimana dua orang masuk ke dalam BSC untuk belajar menyemai sel yang telah di-thawing dan menumbuhkannya pada dua medium berbeda setiap well nya yakni Medium A dan B.
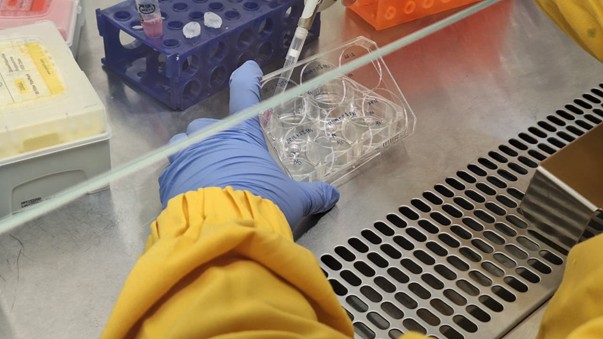
Gambar 6. Proses seeding cells ke dalam 6-well plate
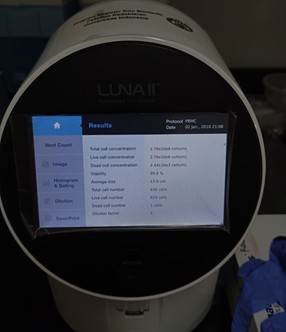
D. Perhitungan Sel (Counting of Cells)
Perhitungan sel (cell counting) adalah langkah penting dalam kultur sel untuk menentukan densitas sel dan viabilitas sebelum melanjutkan ke proses seperti seeding, passaging, atau eksperimen downstream. Salah satu metode tradisional yang sering digunakan untuk menghitung sel adalah manual counting menggunakan hemocytometer. Pada metode ini, sel dicampur dengan trypan blue untuk membedakan sel hidup dan mati, lalu ditempatkan di hemocytometer. Jumlah sel dihitung dalam kotak hitungan tertentu, kemudian densitas sel dihitung dengan rumus. Untuk sel yang masih hidup, ia akan berwarna terang. Sedangkan sel yang sudah mati akan berwarna biru, berikut adalah ilustrasi protokol kerja penghitungan sel secara manual.
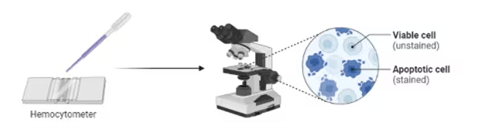
Gambar 7. Prosedur kerja perhitungan sel secara manual dan sederhana
Umumnya saat pengamatan sel pada mikroskop, diamati 4 bilik besar yang berada di kanan atas dan bawah, serta kiri atas dan bawah. Setiap lab pada dasarnya memiliki peraturan perhitungan tertentu, misalnya dalam satu bilik sel yang menempel pada garis luar atas dan kiri tidak dihitung ataupun kebalikannya. Para peserta seperti pada Gambar 8 melakukan pengamatan dan pencatatan jumlah sel hidup dan mati pada lembar kerja. Hal ini untuk memudahkan perhitungan jumlah sel per mL dan viabilitas sel. Adapun untuk rumus yang digunakan pada perhitungan secara manual adalah sebagai berikut.



Gambar 8. Proses perhitungan sel oleh peserta
- Gambar 9. Pengamatan dan perhitungan sel secara manual
- Gambar 10. Perhitungan sel dengan automatic cell counter
Sebagai alternatif, sel juga dapat dihitung secara otomatis menggunakan alat yang bernama automatic cell counter. Selain menghitung jumlah sel dan viabilitas, alat ini dapat memberikan informasi mengenai ukuran rerata dari sel. Penggunaan alat ini dapat digunakan untuk meningkatkan kecepatan dan konsistensi perhitungan sel. Alat ini menggunakan teknologi seperti image analysis atau impedansi listrik untuk menghitung sel hidup dan mati secara otomatis. Keuntungan menggunakan automatic cell counter adalah lebih cepat, lebih reproducible, dan mengurangi subjektivitas operator meskipun biaya alat lebih tinggi dibandingkan metode manual. Banyak penelitian modern mengkombinasikan kedua metode yakni manual untuk kontrol kualitas awal dan automatic counter untuk eksperimen berskala besar.
E. Pemanenan Sel (Harvesting Cells)
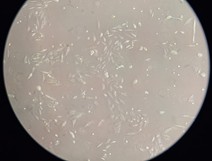
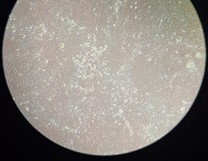
Pemanenan sel (cell harvesting) adalah langkah penting dalam kultur sel di mana sel yang telah tumbuh di permukaan atau dalam medium dipisahkan dari wadah kultur untuk analisis lebih lanjut, subkultur, atau aplikasi lainnya. Flask T25 yang berisi cells A549 ditumbuhkan pada dua medium yang berbeda. Setelah pengamatan hari ke-3 terdapat perbedaan penampakan sel dan konfluensi sel sebagai berikut.
DMEM High Glucose + FBS 10% RF12 + FBS 2%
- Gambar 11. Penampakan Cells A549 yang ditumbuhkan dengan medium DMEM belum konfluens pada pengamatan hari ke-3
- Gambar 12. Penampakan Cells A549 yang ditumbuhkan dengan medium DMEM sudah konfluens dan menumpuk (overgrown) pada pengamatan hari ke-3
Dari gambar di atas, peserta dan panitia dapat melihat bahwa sel yang ditumbuhkan pada medium RF12 memiliki percepatan proliferasi dibandingkan dengan sel yang dibutuhkan dengan medium standard DMEM dan 10% FBS. Hal ini menunjukan bahwa medium RF12 selain menjawab permasalahan mengenai isu penggunaan FBS, juga memberikan hasil yang lebih baik untuk kinerja di laboratorium sel kultur.
Setelah sel mencapai konfluensi dengan persentase yang besar (90 – 100%), para peserta dapat memutuskan dua hal yakni sel dapat disubkultur atau sel dapat dibekukan apabila sel belum akan digunakan dalam waktu dekat ini. Adapun dalam kegiatan workshop kali ini, peserta dan panitia melakukan pembekuan sel atau kriopreservasi sel.
Langkah awal untuk pemanenan sel (baik akan disubkultur ataupun di kriopreservasi), sel harus didetasemen dan dihitung kembali untuk menentukan jumlah sel yang akan ditanam pada flask baru (subkultur) atau jumlah sel yang di kriopreservasi. Untuk sel adheren, langkah detasemen (detachment) dari permukaan kultur menggunakan enzymatic detachment seperti trypsin/EDTA yang memecah protein adhesi antara sel dan substrat sehingga sel dapat dilepaskan dalam bentuk suspensi. Proses ini harus dilakukan secara terkontrol dan aseptik karena detasemen yang terlalu kuat atau lama dapat mempengaruhi viabilitas dan fenotip sel setelah dipanen, terutama jika target analisis melibatkan permukaan protein atau tanda biologis tertentu.
Pada saat proses detachment ini, sel dicuci terlebih dahulu dengan PBS sebanyak 2 kali untuk kemudian diberikan Trypsin dari Nacalai dan diinkubasi selama 2 menit pada CO2 incubator. Setelah 2 menit, sel kemudian diamati di bawah mikroskop apakah sudah lepas semua atau masih menempel pada flask. Para peserta mengamati sel seperti pada Gambar 13. Berdasarkan pengamatan peserta, sel yang diberi medium Nacalai langsung lepas semua sehingga bisa langsung digunakan untuk tahapan selanjutnya. Panitia juga menyampaikan bahwa produk trypsin Nacalai memberikan hasil yang lebih cepat dalam melepaskan sel dibandingkan produk yang rutin mereka pakai dimana produk mereka membutuhkan waktu inkubasi yang lebih lama dibandingkan trypsin Nacalai.

Gambar 13. Proses pengamatan sel setelah pemberian trypsin
F. Kripreservasi (Cryopreservation Cells)
Kriopreservasi sel adalah proses menyimpan sel hidup pada suhu sangat rendah, biasanya menggunakan nitrogen cair (-196°C). Hal ini bertujuan untuk menghentikan aktivitas metabolik dan menjaga viabilitas sel untuk penggunaan di masa mendatang. Tujuan utama kriopreservasi adalah mempertahankan kualitas, fenotipe, dan kemampuan proliferatif sel sehingga kultur sel dapat diregenerasi tanpa kehilangan karakteristik biologisnya.
Sebelum dibekukan, biasanya sel dihitung terlebih dahulu jumlahnya agar dapat memastikan berapa banyak sel yang dibekukan. Informasi ini bersifat penting untuk dapat memperkirakan jumlah sel yang dapat di-thawing pada waktu selanjutnya. Setelah memasikan jumlah sel, kemudian sel dicampur dengan cryoprotectant seperti DMSO (dimethyl sulfoxide) atau glycerol yang berfungsi mencegah terbentuknya kristal es di dalam sel yang bisa merusak membran dan organel sel. Proses pembekuan biasanya dilakukan secara bertahap, misalnya 1°C per menit hingga mencapai suhu penyimpanan, untuk meminimalkan stres osmotik dan kerusakan mekanik pada sel. Adapun beberapa proses lainnya yang umum digunakan yakni penyimpanan sementara pada -80°C untuk beberapa saat, kemudian pemindahan sel pada nitrogen cair.
Setelah disimpan, sel dapat di thawing (dicairkan) dan dikultur kembali, dengan catatan bahwa langkah thawing harus dilakukan cepat dan hati-hati untuk memaksimalkan viabilitas sel. Beberapa studi menunjukkan bahwa metode kriopreservasi yang optimal memungkinkan sel mempertahankan viabilitas >80% setelah thawing, dan dapat digunakan untuk berbagai aplikasi. Dengan kriopreservasi, laboratorium dapat mengurangi kebutuhan subkultur yang terus-menerus, meminimalkan risiko mutasi atau perubahan genetik, dan menjamin ketersediaan sel yang konsisten untuk eksperimen reproducible.
Pada kesempatan workshop ini, para peserta menggunakan Cell Reservoir One (without DMSO) untuk melakukan cryopreservasi. Berikut adalah contoh cryovial sel Human Lung Cancer A549.
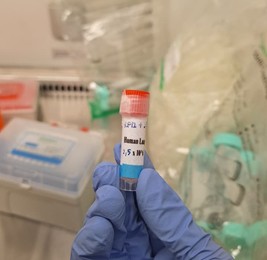
Gambar 14. Cryovial Human Lung Cancer A549
III. Pengenalan Medium Brand Nacalai
Nacalai Tesque Inc., menyajikan beragam produk medium untuk penelitian sel kultur. Inovasi RF12 ini memberikan gagasan yang besar untuk dunia sel kultur dengan hasil yang lebih baik. Pada saat optimasi, kami dan panitia juga mencoba melakukan thawing dari cryovial yang kami buat. Adapun dari beberapa kali percobaan, viabilitas sel setelah thawing yakni 100% dan terendah di 99% sehingga produk Cell Reservoir One(without DMSO) cocok untuk peneliti yang memiliki concern terkait penyimpanan dalam jangka waktu lama namun masih mengkhawatirkan terkait viabilitas sel yang menurun seiring berjalannya waktu.
Berikut adalah daftar produk yang digunakan dalam kegiatan workshop ini.
| Nomor Catalog | Nama Produk |
| 21906-55 | Reduced Serum DMEM/Ham’s F-12 Medium |
| 08459-35 | DMEM(4.5g/l Glucose) with L-Gln, without Sodium Pyruvate, liquid |
| 14249-95 | D-PBS(-) without Ca and Mg, liquid |
| 32777-44 | 2.5g/l-Trypsin/1mmol/l-EDTA Solution, with Phenol Red |
| 07579-24 | Cell Reservoir One(without DMSO) |
| 02892-54 | Antibiotic-Antimycotic Mixed Stock Solution(100x) |
| 20577-34 | 0.5%-Trypan Blue Stain Solution |
Sebagai bentuk dukungan untuk kegiatan riset para peserta yang antusias terhadap dunia sel kultur, Nacalai Tesque Inc., melalui PT Indogen Intertama memberikan medium RF12 kepada peserta dengan nilai tertinggi dan peserta pemenang doorprize. Peserta yang memenangkan nilai terbaik merupakan staf dari Laboratorium Stem Cell dan peserta pemenang doorprize adalah staf pengajar (dosen) yang sedang melakukan studi S3 di FKUI.

Gambar 15. Pemberian Doorprize Medium RF12 kepada Peserta Pemenang