Pelatihan Flow Cytometry Ekspresi Antibodi Membran dan Deteksi T/B/NK (5 Warna) pada Limpa Mencit di Laboratorium Elabscience, Wuhan, Cina
A. Pengantar Pelatihan FCM
Flow cytometry (FCM) adalah pengujian laboratorium yang cepat, objektif, stabil, dan signifikan secara statistik yang dapat menguji jenis sampel kompleks dan kemudian memperoleh beberapa parameter sekaligus. Teknik FCM dapat menentukan sifat biologis sel tunggal dalam suspensi sel, dan dapat memilah, mengidentifikasi, dan bahkan mengisolasi populasi sel tertentu. FCM digunakan secara luas dalam penelitian biologi sel, imunologi, pensinyalan selular, pengujian efikasi obat, mikrobiologi, dan bidang lainnya.
Analisis dan deteksi FCM didasarkan pada pengujian sel atau partikel tunggal. Untuk memperoleh hasil eksperimen FCM yang reprodusibel, sampel harus disiapkan menjadi suspensi sel atau partikel tunggal. Agregat sel atau gumpalan sel dapat dengan mudah menyumbat instrumen dan terlalu banyak debris sel dapat menyebabkan hasil pengujian tidak valid.
Antibodi Flow Cytometry dari Elabscience memiliki beragam pilihan fluorokrom dan beragam target protein ekstraseluler (protein membran) dan intraseluler (sitoplasma atau inti) yang dapat dipilih untuk mengidentifikasi dan mengkuantifikasi populasi sel secara efisien, serta mengkarakterisasi fungsi sel dengan mudah.
Kegiatan pelatihan ini dilakukan dan diawasi oleh Lim dari Departemen QC/QA dan Richard dari Departemen Technical Support Elabscience yang mendampingi proses pengujian TUNEL Assay.
B. Bahan dan Alat
- Alkohol 70% atau 75% (dalam bejana)
- Meja operasi steril
- Gunting ophthalmic
- Tweezer (Forcep)
- Phosphate buffer (PBS, 1 ×) [Elabscience #PB180327]
- DMEM (High glucose), without phenol red [Elabscience #PM150223]
- Mortar dan tissue grinder
- Mikropipet single-channel (0.5 – 1000µL)
- Tips (0.5 – 1000µL)
- Cell Strainer / Nylon Filter Mesh / Paper Filter (ukuran 200-mesh)
- Tabung sentrifus 15mL dan 50mL
- Tabung mikrosentrifus 2mL atau 3mL
- Syringe disposable
- Petri dish disposable
- TC Culture Plate, 96-well plate
- Cell Staining Buffer [Elabscience #E-CK-A107]
- 10×ACK Lysis Buffer [Elabscience #E-CK-A105]
- FITC Anti-Mouse CD3 Antibody[17A2] [E-AB-F1013C]
- Elab Fluor® Violet 450 Anti-Mouse CD4 Antibody[RM4-5] [Elabscience #E-AB-F1353UQ]
- PerCP/Cyanine5.5 Anti-Mouse CD8a Antibody[53-6.7] [Elabscience #E-AB-F1104UJ]
- APC Anti-Mouse CD19 Antibody[1D3] [Elabscience #E-AB-F0986E]
- PE Anti-Mouse CD161/NK1.1 Antibody[PK136] [Elabscience #E-AB-F0987D]
- PE Mouse IgG2a, κ Isotype Control[C1.18.4] [Elabscience #E-AB-F09802D]
- FcR Blocker – Purified Anti-Mouse CD16/32 Antibody[2.4G2] [Elabscience #E-AB-F0997A]
- ddH2O steril
- Counting Chamber Neubauer
- Timer
- Incubator
- Kulkas 4°C
- Centrifuge
- Mini spindown centrifuge
- NovoCyte Quanteon Flow Cytometer
C. Preparasi Suspensi Sel Tunggal Limpa Mencit
- Lakukan eutanasia pada mencit dengan dislokasi serviks dan rendam tubuh dalam alkohol 70% atau 75% selama 5 menit, kemudian letakkan tubuh mencit pada meja operasi steril dengan sisi ventral kiri menghadap ke atas.
- Buat sayatan kecil di bagian tengah sisi ventral kiri mencit dengan menggunting lapisan kulit menggunakan gunting ophthalmic. Gunting kulit hingga terbuka dan dinding abdomen (peritoneum) tampak. Limpa berwarna merah dengan bentuk memanjang akan terlihat.
- Buka lapisan peritoneum dan ambil limpa dari bagian bawah dengan cara memegang limpa dengan forcep dan memotong jaringan ikat di bagian bawah limpa. Limpa yang diambil kemudian direndam dalam larutan PBS yang bersih atau medium kultur tanpa phenol red (medium kultur digunakan untuk menjaga aktivitas sel).

- Tambahkan 1 mL PBS ke dalam mortar steril dan letakkan limpa di dalam mortar. Giling limpa dengan tissue grinder secara perlahan hingga hancur dan tidak ada lagi gumpalan merah dari organ limpa yang telah dihaluskan. Tambahkan 2 mL PBS dan pipet atas-bawah hingga homogen merata.
- Siapkan tabung sentrifus (15mL atau 50mL) dan Cell Strainer (200 ~ 400 mesh), lalu letakkan Cell Strainer di atas tabung. Tuang dan saring larutan jaringan limpa halus ke dalam tabung. Filtrat yang diperoleh kemudian disentrifugasi dengan kecepatan 300g selama 5 menit.

- Preparasi 1×ACK Lysis Buffer dengan perbandingan ratio 1:9 untuk 10×ACK Lysis Buffer dan ddH2O. Setelah sentrifugasi, buang cairan supernatan dan tambahkan 2 mL 1x ACK Lysis Buffer untuk resuspensi sel dengan cara memipet atas-bawah. Lisis dilakukan pada suhu ruangan selama 2 menit.
- Setelah 2 menit proses lisis eritrosit, segera tambahkan 10 mL PBS dan sentrifus pada 300g selama 5 menit. Buang supernatan setelah sentrifugasi.
- Resuspensi sel-sel dengan 3 mL Cell Staining Buffer dan homogenkan dengan pipet. Saring kembali suspensi sel dengan Cell Strainer (200 mesh) dan kumpulkan dalam tabung sentrifus baru.
- Hitung konsentrasi sel dengan Counting Chamber Neubauer. Sesuaikan jumlah konsentrasi sel menjadi 1×107/mL dengan Cell Staining Buffer.
Catatan:
- Untuk limpa berukuran normal, jumlah sel limpa sekitar 4×107 dapat diperoleh berdasarkan pengalaman panen limpa sebelumnya. Jumlah sel limpa sebenarnya bergantung pada hasil penghitungan oleh personel laboratorium.
- Jika tidak ada tissue grinding rod dan mortar, plunger karet dalam syringe juga dapat digunakan sebagai gantinya. Giling limpa dengan bantalan karet di ujung plunger di atas disposable petri-dish.
- Pada tahap lisis eritrosit, waktu lisis ditentukan oleh efek fission selama percobaan.
D. Pewarnaan T/B/NK Sel Limpa Mencit
- Siapkan suspensi sel limpa dengan konsentrasi 1×107/mL
- Buat panel antibodi yang akan dilakukan:
Tabung Panel Antibodi Multi-color Blanko None CD3-FITC CD3-FITC CD4-EV450 CD4-Elab Fluor® Violet 450 CD8-PC5 CD8-PerCP/Cyanine5.5 CD19-APC CD19-APC NK1.1-PE NK1.1-PE ISO-PE (Isotype) CD3-FITC CD4-Elab Fluor® Violet 450
CD8-PerCP/Cyanine5.5
CD19-APC
Mouse IgG2a,k Isotype Control-PE
Full CD3-FITC CD4-Elab Fluor® Violet 450
CD8-PerCP/Cyanine5.5
CD19-APC
NK1.1-PE
- Siapkan 8 tabung mikrosentrifus steril (2mL, 2.5mL atau 3mL) dan beri label pada setiap tabung dengan kode tabung pada tabel di atas. Tambahkan 100µL suspensi sel limpa ke setiap tabung.
- Sentrifus setiap vial antibodi dengan Mini Spindown Centrifuge pada kecepatan rendah selama 30 detik hingga 1 menit untuk menghomogenkan antibodi dalam setiap vial.
- Blokir pengikatan nonspesifik dengan menambahkan 1μg FcR Blocker (CD16/32) ke semua tabung mikrosentrifus. Inkubasi pada suhu ruangan selama 10 menit dan tanpa paparan cahaya.
- Tambahkan 5μL antibodi ke setiap tabung mikrosentrifus berdasarkan Panel FCM yang tercantum dalam tabel di atas. Untuk tabung kosong, tidak ada penambahan antibodi dari Panel.
- Inkubasi pada suhu 4°C selama 30 menit dan tanpa paparan cahaya. Setelah inkubasi, tambahkan 2 mL Cell Staining Buffer ke setiap tabung mikrosentrifus dan homogenkan setiap tabung dengan vortex mixer.
- Sentrifus tabung pada kecepatan 300 g selama 5 menit. Buang supernatan dari semua tabung mikrosentrifus. Kemudian tambahkan 200µL ke setiap tabung dan resuspensikan dengan vortex mixer.

- Siapkan TC 96-well plate untuk analisis FCM High-Throughput. Dalam percobaan ini, kami memuat 200µL sampel yang telah diwarnai ke dalam sumuran G1 – G8 dengan urutan sebagai berikut: Blanko, CD3-FITC, CD4-EV450, CD8-PC5, CD19-APC, NK1.1-PE, Isotype-PE, dan Full Panel.
- Sampel dengan Panel FCM kemudian dianalisis menggunakan NovoCyte Quanteon yang terintegrasi dengan NovoSampler Q dengan bantuan program software NovoExpress. Catatan: Analisis dapat dilakukan menggunakan Flow Cytometer jenis apa pun dan dapat dilakukan dengan instrumentasi yang hanya menggunakan single-sampler (non High-Throughput). Analisis harus dilakukan oleh personel laboratorium yang terampil dan terlatih menggunakan program cytometer, atau setidaknya dipandu dan didampingi oleh personel tersebut selama analisis.
E. Setting Up Cytometer dan Akuisisi Data
- Nyalakan mesin dan komputer yang terhubung ke NovoCyte Flow Cytometer. Masuk ke program NovoExpress dengan mengisi keterangan Facility, Username, dan Password jika diperlukan oleh proses Login. Setelah masuk, Interface Utama akan terlihat.
- Langsung masuk ke bagian ‘Plate Manager‘ dan gunakan format 96 well-plate untuk High-Throughput yang nantinya akan dibantu oleh robotic arm liquid handler. Pilih jenis ‘Mode’ dengan ‘Custom’. Pilih bagian ‘Plate’ untuk jumlah 1 (satu), format ’96 well-plate (Rat bottom)’.
- Pilih ‘Mix’ untuk ‘1 Cycle’ dan ‘Every’ untuk ‘1 well’, dengan tujuan untuk melakukan vortexing dan homogenisasi. Atur ‘Mixing Parameters’ sesuai dengan kebutuhan (misal speed 100 rpm dengan duration 10 detik dan acceleration 1). Catatan: ‘Mixing Parameters’ harus disesuaikan dengan volume sampel dalam wadah, dan jangan melakukan vortex terlalu keras agar tidak ada sampel yang tumpah.
- Pilih bagian ‘Rinse’ untuk 1 Cycle dan ‘Every’ untuk 1 well.
- Centang kotak ‘Absolute Count’.
- Menuju bagian ‘Cytometer Setting’. Lihat bagian ‘Parameter’ dan lihat daftar periksa daftar parameter FCM dengan instrumen yang digunakan. Semua yang dicentang akan aktif selama akuisisi, jadi pengguna perlu memastikan bahwa hanya parameter yang diperlukan yang aktif selama proses akuisisi. Klik dua kali pada ‘Area (A)’ dan ‘Height (H)’ untuk membatalkan pilihan atau menghapus centang pada setiap kotak parameter. Kemudian pilih/centang kotak untuk detektor yang diaktifkan yang akan aktif selama akuisisi.
- Setelah memilih parameter yang diinginkan, nama setiap parameter dapat diubah sesuai dengan preferensi pengguna.
- Jika perlu, setel ‘Gain’ sebelum menjalankan akuisisi berdasarkan kebutuhan Anda. Catatan: Jika bagian ‘Gain’ untuk parameter yang dipilih telah diubah oleh pengguna sebelumnya untuk kebutuhan tertentu, klik dua kali pada ‘Gain’ dan klik ‘Reset All’ untuk kembali ke default.
- Langsung ke ‘Plate Manager’ lalu pilih sumur G1-G8 dan pilih ‘New’. Lihat di bagian ‘Experiment Manager’ apakah ‘G1:Sample1’ hingga ‘G8:Sample8’ telah muncul. Untuk menyesuaikan nama sampel sesuai keinginan, klik kanan dan pilih ‘Rename’ lalu beri nama sesuai tabung pada Tabel di atas. Penggantian nama dapat dilakukan di window ‘Worklist’ dengan mengklik ikon ‘Workslit’ dan nama dapat diubah sesuai keinginan. Tutup jendela dan klik ‘Yes’ untuk ‘Apply modified worklist’. Catatan: Jika nama sampel ada di worksheet Excel, silakan salin dan tempel nama tersebut.
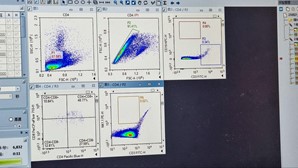
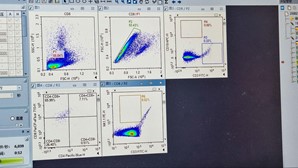
- Pada toolbar di atas bagian median dari interface Utama, pilih ikon ‘Dot Plot’ dan buat 5 buah Dot Plot. Sesuaikan parameter setiap plot sumbu X dan sumbu Y sebagai berikut:
Plot-1: Sumbu X = FSC-H; Sumbu Y = SSC-H
Plot-2: Sumbu X = FSC-A; Sumbu Y = FSC-H
Plot-3: Sumbu X = CD3-FITC-H; Sumbu Y = CD19-APC-H
Plot-4: Sumbu X = CD8-PerCP_eFluor710-H; Sumbu Y = CD4-PacificBlue-H
Plot-5: Sumbu X = NK1.1-PE-H; Sumbu Y = CD3-FITC-H
- Kemudian menuju ke ‘Stop Condition’ dan sesuaikan volume untuk akuisisi stop untuk lebih rendah dari volume sampel dalam tabung untuk mencegah masuknya udara saat akuisisi (misalnya, 20 – 50uL). Pilih juga jumlah sel sebagai ‘Events on’ dalam mode ‘Ungated‘ untuk kondisi pemberhentian.
- Sesuaikan ‘Flow Rate’ jika perlu.
- Sesuaikan ‘Threshold’ dengan FSC-H lebih besar dari 10000, dan pilih ‘Storage Gate: Ungated’.
- Untuk menerapkan parameter yang dibuat ke sumur G1, pada ‘Experiment Manager’, tariklah ikon ‘Cytometer Setting’ dari G1:Blank dan jatuhkan ke ikon ‘Sample’. Kotak dialog akan muncul menanyakan ‘Are you sure you want to paste Cytometer Setting to all samples in Sample?‘ dan klik ‘Yes‘. Harap periksa setiap sumur (G1 – G8) untuk memastikan bahwa setiap setiap telah diterapkan ke semua sampel.
- Menuju ‘Experimental Control’ di sudut kiri bawah. Klik ‘Run Plate’ dan window ‘Select Wells To Run‘ dan pilih sumur yang akan diakuisisi dan klik ‘Run’.
- Setelah well-plate selesai dijalankan, jendela ‘Save As‘ akan muncul untuk menyimpan file di komputer. Catatan: Gunakan nama eksperimen yang unik untuk diri sendiri atau untuk eksperimen jika instrumentasi tersebut secara rutin digunakan oleh banyak pengguna.
F. Kompensasi, Strategi Gating dan Analisis
- Analisis dapat dilakukan menggunakan software NovoExpress dengan komputer jarak jauh yang dapat dilakukan dengan mengekspor berkas data akuisisi ke Server. Catatan: Sistem akan selalu memperbarui penyimpanan data ke Server setiap setengah jam secara otomatis, sehingga pengguna tidak perlu khawatir tentang cara menyimpan data.
- Untuk analisis jarak jauh, hubungkan komputer atau laptop ke Server yang sama, lalu unduh file dan gunakan software NovoExpress pada laptop yang digunakan untuk analisis data.
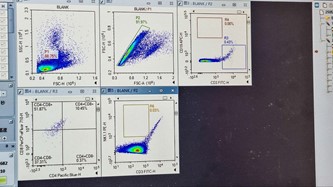
(Sampel Blanko)
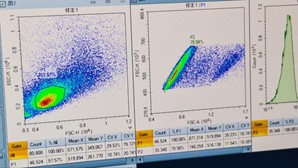
- Pada ikon sampel ‘BLANK’ untuk kompensasi, geser kursor sumbu X dan Y hingga Blank Plot-1 (FSC-H vs. SSC-H) menunjukkan populasi sel di tengah plot dan terpisah dengan jelas. Lakukan gating poligonal pada populasi sel, yang akan menghasilkan populasi P1.
- Pada Plot-2 Blank/P1 (FSC-A vs. FSC-H), kompensasikan dengan menggeser kursor sumbu X dan Y hingga tampilan menunjukkan populasi sel berada di tengah dan terpisah dengan jelas. Lakukan gating persegi panjang pada populasi P1 untuk memisahkan sel tunggal dari sel doublet dan agregat. Hasil gating Plot-2 Blank/P1 akan menghasilkan populasi P2.
- Untuk menerapkan strategi gating sampel Blanko ke semua sampel lainnya, seret ikon ‘BLANK’ dan letakkan di atas ikon ‘Sample’, lalu tekan ‘Yes‘ untuk kotak dialog yang muncul.
(Sampel CD3)
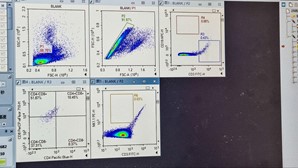
- Pada ikon sampel ‘CD3‘ untuk kompensasi, gerakkan kursor sumbu X dan Y hingga tampilan populasi sel berada di tengah Plot-3 CD3/P2 (CD3-FITC-H vs. CD19-APC-H) dan hingga populasi sel terpisah dengan jelas. Lakukan gating persegi atau 4-kuadran pada populasi sel positif (bagian kanan), sehingga menghasilkan populasi R3.
- Untuk menerapkan strategi gating pada sampel CD3 ke semua sampel lainnya, seret ikon ‘CD3‘ dan letakkan pada ikon ‘Sample‘ lalu tekan ‘Yes‘ di kotak dialog yang muncul.
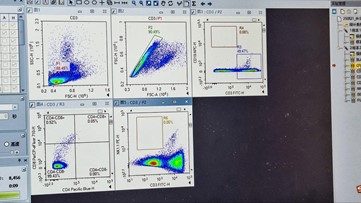
(Sampel CD4 dan sampel CD8)
- Pada Plot-4 CD4/R3 (CD8-PerCP_eFluor710-H vs. CD4-PacificBlue-H), kompensasikan dengan menggerakkan kursor sumbu X dan Y hingga tampilan menunjukkan populasi sel berada di tengah. Lakukan gating 4-kuadran (CD4-CD8+, CD4+CD8+, CD4+CD8-, CD4-CD8-) pada populasi untuk menghasilkan hasil gating dengan populasi negatif, yaitu CD4-CD8-.
- Untuk menerapkan strategi gating pada sampel CD4 ke semua sampel lainnya, seret ikon ‘CD3‘ dan letakkan pada ikon ‘Sample’ lalu tekan ‘Yes‘ di kotak dialog yang muncul.
- Pastikan Plot-4 CD8/R3 pada ikon sampel ‘CD8’ sama dengan ikon sampel ‘CD4’.
(Sampel CD19)
- Pada ikon sampel ‘CD19’, lakukan kompensasi tampilan Plot-3 CD8/P2 (CD3-FITC-H vs. CD19-APC-H) jika perlu dan lakukan gating persegi panjang pada populasi positif (bagian atas), sehingga menghasilkan populasi R4.
- Untuk menerapkan strategi gating pada sampel CD19 ke semua sampel lainnya, seret ikon ‘CD19’ dan letakkan pada ikon ‘Sample’ dan tekan ‘Yes’ di kotak dialog yang muncul.
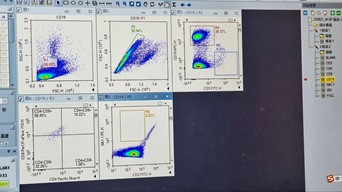
(Sampel NK1.1)
- Pada ikon sampel ‘1’, lakukan kompensasi tampilan Plot-5 NK1.1/P2 (NK1.1-PE-H vs. CD3-FITC-H) jika perlu dan lakukan gating persegi panjang pada populasi positif, sehingga menghasilkan populasi R6.
- Untuk menerapkan strategi gating pada sampel NK1.1 ke semua sampel lainnya, seret ikon ‘1’ dan letakkan pada ikon ‘Sample’ dan tekan ‘Yes’ di kotak dialog yang muncul.
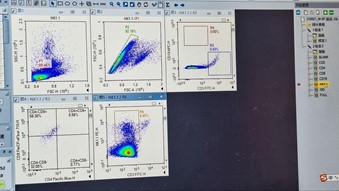
(Sampel ISO-PE : Kontrol FMO)
- Pastikan setiap Plot (ISO, ISO/P1, ISO/P2, ISO/R3, ISO/P2) telah menerapkan modul strategi gating dari setiap proses gating yang telah dilakukan sebelumnya. Jika kompensasi diperlukan untuk plot tertentu, lakukan kompensasi dengan menggerakkan kursor sumbu X dan sumbu Y pada plot tersebut.
- Untuk menerapkan perubahan (kompensasi) sampel Isotype-PE untuk semua sampel lainnya, seret ikon ‘ISO‘ dan letakkan pada ikon ‘Sample’ dan tekan ‘Yes’ di kotak dialog yang muncul.
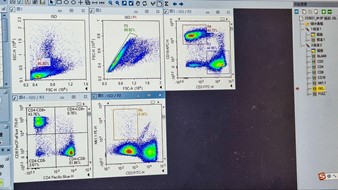
(Sampel Full-Experiment)
- Pastikan setiap Plot (FULL, FULL/P1, FULL/P2, FULL/R3, FULL/P2) telah menerapkan modul strategi gating dari setiap proses gating yang telah dilakukan sebelumnya. Jika kompensasi diperlukan untuk plot tertentu, lakukan kompensasi dengan menggerakkan kursor sumbu X dan sumbu Y pada plot tersebut.
- Untuk menerapkan perubahan sampel Full-Experiment untuk semua sampel lainnya, seret ikon ‘FULL‘ dan letakkan pada ikon ‘Sample‘ dan tekan ‘Yes‘ untuk kotak dialog yang muncul.
- Hasil populasi sel T, sel B, dan sel NK dari limpa mencit ditunjukkan pada plot-plot yang diperoleh pada sampel FULL.
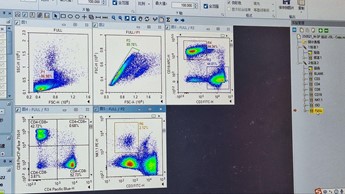
Hasil Terkoreksi Sel T/B/NK
| Sampel | Hasil Analisis FCM |
| Blanko | 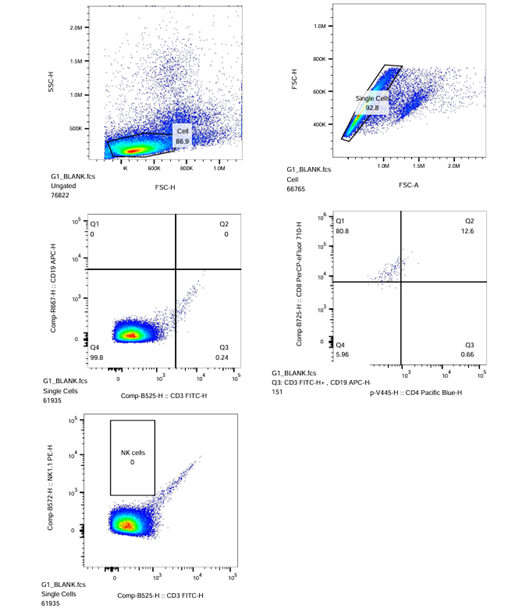 |
| CD3-FITC | 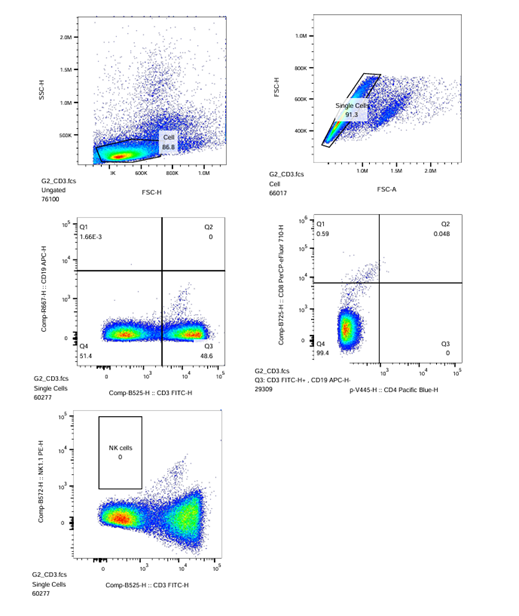 |
| CD4-EV450 | 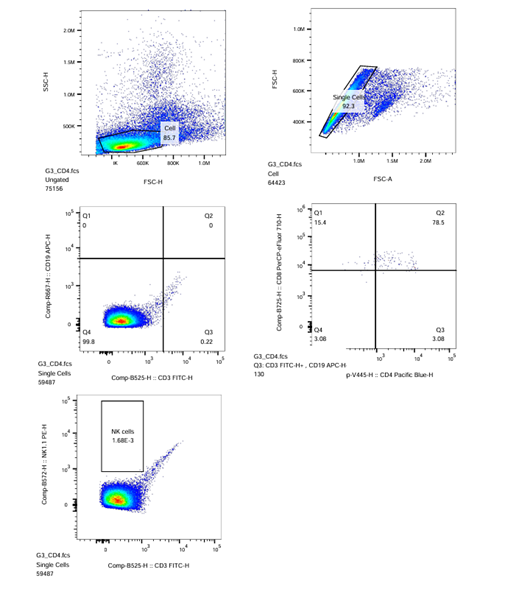 |
| CD8-PC5 | 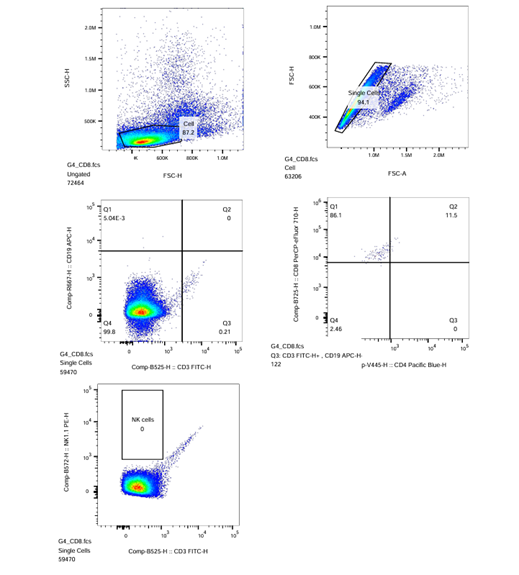 |
| CD19-APC | 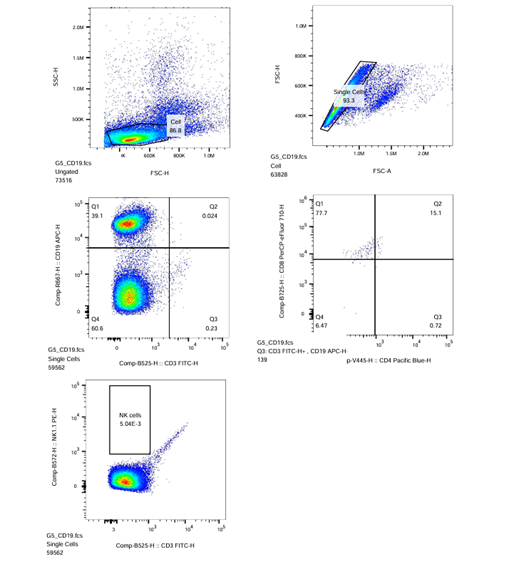 |
| NK1.1-PE | 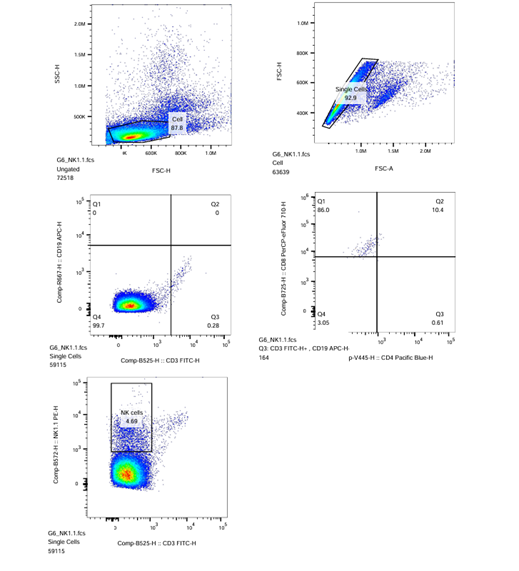 |
| ISO-PE | 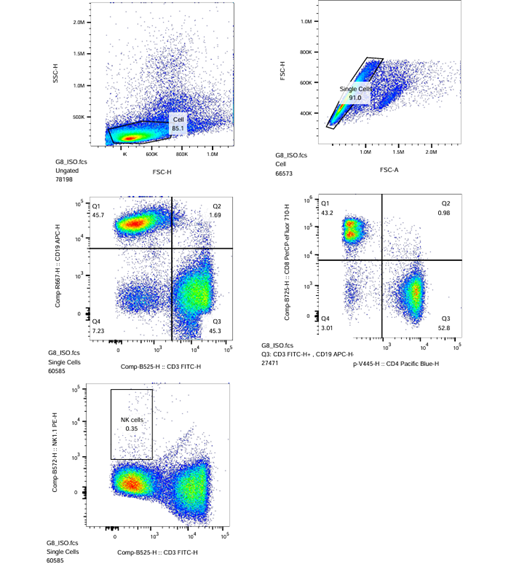 |
| Full | 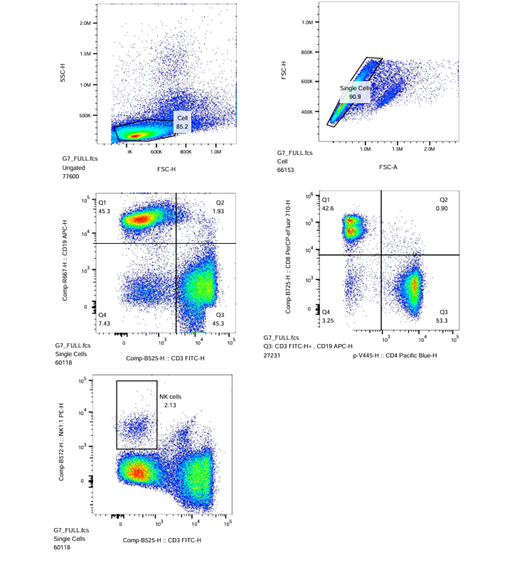 |