Mengenal Prinsip Dasar CRISPR dan Cloning Tools: Studi Kasus OriGene dan Cyagen
Pendahuluan
Teknologi rekayasa genetika telah mengalami kemajuan pesat dalam beberapa dekade terakhir, terutama dengan kemunculan alat mutakhir seperti CRISPR dan cloning tools. CRISPR atau Clustered Regularly Interspaced Short Palindromic Repeats memungkinkan modifikasi DNA secara presisi dan efisien, mengubah paradigma riset genetik dan terapi genetik (Doudna & Charpentier, 2014).
Awalnya, teknologi CRISPR merupakan bagian dari sistem imun adaptif yang ditemukan pada bakteri dan archaea. Sistem ini memungkinkan mikroorganisme tersebut mengenali dan melawan serangan virus dengan menyimpan fragmen DNA virus yang pernah menyerang di dalam urutan DNA berulang-ulang yang khas (Jinek dkk., 2012). Dengan kata lain, CRISPR berfungsi sebagai “memori genetik” yang membantu mengenali DNA asing dan melindungi diri dari infeksi di masa depan. Sistem ini bekerja bersama protein-protein khusus yang mampu mengenali dan memotong DNA asing tersebut. Pengembangan teknologi dari sistem CRISPR ini telah memberikan kemajuan besar dalam bioteknologi, terutama pada bidang penyuntingan genom, kloning gen, dan aplikasi klinis maupun agrikultural (Ran dkk., 2013). Prinsip dasar CRISPR melibatkan pengenalan urutan target DNA secara spesifik, sehingga memungkinkan modifikasi genetik yang presisi dan efisien.
Selain teknologi CRISPR, berbagai cloning tools juga memegang peranan penting dalam manipulasi DNA dan rekayasa genetika. Cloning tools memegang peranan penting dalam proses penggandaan DNA, yang menjadi dasar bagi berbagai aplikasi riset dan terapi genetik. Cloning tools, seperti enzim restriksi dan plasmid vektor, merupakan dasar penting dalam manipulasi genetik, memungkinkan penggandaan dan analisis gen tertentu (Sambrook & Russell, 2001).
Teknik kloning tradisional menggunakan enzim restriksi dan ligase untuk memotong dan menyambung fragmen DNA, sedangkan alat-alat modern kini telah berkembang untuk mempermudah dan mempercepat proses tersebut. Contohnya, teknologi Golden Gate cloning, Gateway cloning, dan Gibson assembly yang memungkinkan penggabungan fragmen DNA secara cepat dan efisien tanpa perlu enzim restriksi spesifik (Engler, Gruetzner, Kandzia, & Marillonnet, 2009; Gibson dkk., 2009).
Integrasi antara teknologi CRISPR dengan alat kloning canggih memungkinkan para peneliti untuk melakukan penyuntingan dan manipulasi gen dengan tingkat presisi yang tinggi, mendukung pengembangan terapi gen dan produksi organisme hasil rekayasa yang lebih cepat dan akurat (Zhang dkk., 2020).
Prinsip Dasar CRISPR
CRISPR adalah sistem pertahanan alami pada bakteri yang digunakan untuk mengenali dan memotong DNA asing, seperti virus. Sistem CRISPR-Cas9, yang dikembangkan untuk aplikasi rekayasa genetika, terdiri dari dua komponen utama: enzim Cas9 dan RNA panduan (sgRNA). Cas9 berfungsi sebagai pemotong DNA, sementara sgRNA mengarahkan Cas9 ke lokasi spesifik pada genom target.
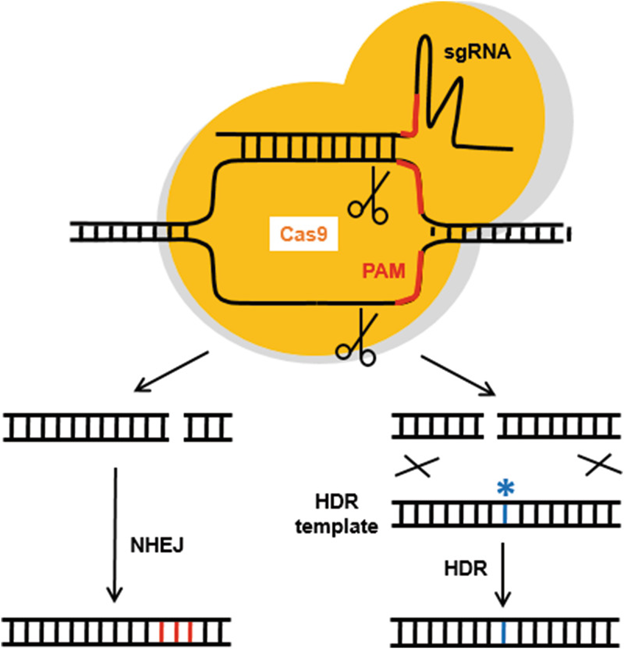
Gambar 1. Penyuntingan gen menggunakan CRISPR-Cas9 (Gnudi dan Long, 2020)
Mulanya, Single guide RNA (sgRNA) dirancang untuk mengenali urutan spesifik pada DNA target. Kemudian, sgRNA akan berikatan dengan Cas9 dan mengarahkan enzim Cas9 ke lokasi target pada DNA. Proses editing dimulai dengan pengikatan sgRNA pada DNA target yang sesuai dengan urutan spesifik. Cas9 kemudian memotong kedua untai DNA pada lokasi tersebut, menghasilkan patahan ganda (double-strand break atau DSB). Selanjutnya, sel akan memperbaiki patahan ini melalui dua jalur utama yakni Non-Homologous End Joining (NHEJ), yang sering menghasilkan mutasi in-del, dan Homology-Directed Repair (HDR), yang memungkinkan penyisipan atau perbaikan urutan DNA yang lebih presisi. NHEJ dapat menyambungkan ujung DNA dengan cepat namun sering menghasilkan mutasi. Sedangkan HDR menggunakan template homolog untuk perbaikan DNA sehingga memungkinkan penyisipan atau perbaikan urutan DNA secara presisi.
Prinsip Dasar Cloning Tools
Dalam dunia rekayasa genetika, enzim restriksi sering digunakan untuk memotong DNA. Namun, metode ini memiliki keterbatasan penting: enzim tersebut tidak bisa memotong DNA di lokasi yang benar-benar spesifik, dan kadang memotong lebih dari satu titik dalam satu sekuens DNA. Sebagai solusi yang lebih presisi, para peneliti kini banyak menggunakan sistem CRISPR-Cas9, yang bekerja seperti “gunting molekuler pintar.” Dengan bantuan single guide RNA (sgRNA), Cas9 dapat diarahkan ke lokasi target tertentu di DNA, asalkan urutan tersebut berada sebelum PAM (Protospacer Adjacent Motif), yaitu sekuens 5′-NRG (R adalah A atau G). Ini membuat CRISPR mampu memotong DNA di hampir lokasi mana pun secara spesifik dan efisien (Wang dkk., 2014).
Menariknya, sebuah penelitian menunjukkan bahwa sistem ini bisa digunakan untuk memotong plasmid berukuran besar (22 kb) secara tepat di laboratorium. Setelah plasmid tersebut dipotong oleh Cas9, fragmen DNA baru disisipkan tanpa bekas (seamless) menggunakan metode Gibson Assembly, yaitu teknik kloning modern yang tidak memerlukan enzim restriksi tambahan. Kombinasi CRISPR dan Gibson Assembly ini membuka peluang baru untuk menyisipkan atau memodifikasi DNA dalam vektor besar yang sebelumnya sulit dimanipulasi dengan metode konvensional.
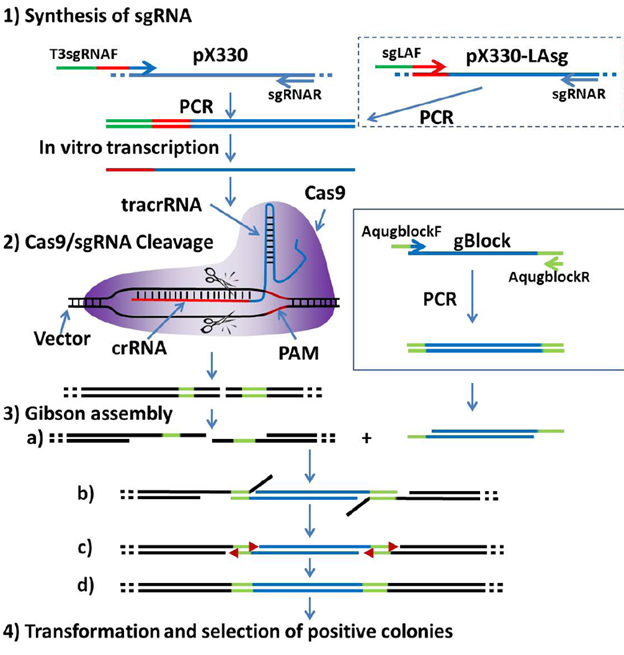
Gambar 2. Diagram skematik metode kloning CRISPR/Gibson (Wang dkk., 2014)
Ilustrasi di atas menggambarkan bagaimana sistem CRISPR/Cas9 dapat digunakan bersama metode Gibson Assembly untuk melakukan kloning DNA secara efisien dan tanpa bekas (seamless). Proses dimulai dengan sintesis single guide RNA (sgRNA) yang dirancang khusus untuk mengenali lokasi target pada plasmid. sgRNA ini kemudian memandu enzim Cas9 untuk memotong plasmid berukuran besar secara presisi, menghasilkan vektor linear. Pada saat yang sama, fragmen DNA yang akan disisipkan dipersiapkan melalui teknik PCR, dengan penambahan sekuens homolog (overhang) di ujung-ujungnya agar cocok dengan ujung plasmid yang telah dipotong.
Selanjutnya, proses Gibson Assembly digunakan untuk menyambungkan fragmen DNA ke dalam vektor. Enzim T5 exonuclease akan mengikis ujung 5′ DNA, menghasilkan ujung tunggal 3′ yang saling komplementer, memungkinkan proses annealing atau penempelan antar fragmen. Setelah itu, DNA polymerase mengisi celah antarfragmen, dan DNA ligase menyatukan semua bagian secara utuh melalui pembentukan ikatan fosfodiester. Hasil akhirnya adalah plasmid baru yang telah dimodifikasi secara spesifik, tanpa adanya sekuens tambahan atau bekas pemotongan. Kombinasi CRISPR dan Gibson Assembly ini menjadi solusi unggul untuk mengatasi keterbatasan metode kloning tradisional, terutama saat bekerja dengan vektor besar atau konstruksi genetik kompleks.
Selain Gibson Assembly, berikut adalah beberapa teknik kloning yang umum digunakan meliputi:
- Restriction Enzyme Cloning
Menggunakan enzim restriksi untuk memotong DNA pada lokasi spesifik, kemudian menyambungkannya ke vektor menggunakan ligase. - PCR-Based Cloning
Menggunakan reaksi rantai polimerase (PCR) untuk mengamplifikasi fragmen DNA, yang kemudian dimasukkan ke dalam vektor. - Ligation-Independent Cloning (LIC)
Teknik yang memungkinkan penyisipan DNA ke dalam vektor tanpa memerlukan enzim ligase, sering kali menggunakan homologi urutan untuk penyisipan.
Studi Kasus Produk OriGene
OriGene adalah perusahaan yang menyediakan berbagai produk untuk penelitian genetik, termasuk plasmid ekspresi, antibodi, dan kit CRISPR. Produk-produk mereka dirancang untuk memfasilitasi penelitian dalam bidang terapi gen, kanker, dan penyakit genetik lainnya. OriGene juga menyediakan jasa yakni CRISPR/Cas9 Gene Editing Cloning Services. Berikut adalah produk yang disediakan oleh brand OriGene.
1. CRISPR/Cas9 Genome Knockout Kits
Kit dari brand OriGene memiliki dua tipe yang berbeda sebagai berikut. Selain itu, juga terlampir berbagai jenis kit yang sudah divalidasi atau digunakan pada beberapa jenis sel line dan publikasi terkait penelitian tersebut.
| HDR mediated | KN2.0 non-homology mediated | |
| gRNA vectors | pCas-Guide | pCas-Guide |
| Donor | Donor cassette flanking with homologous arms | Donor cassette without homologous arms |
| Cell spectrum | Dividing cells | Dividing and non-dividing cells |
| Knockout Efficiency | Medium | High |
| SKU | Cell Lines Tested | Publications |
| KN200003 | A549 | Int J Mol Sci 2017 |
| KN316845 | bEnd5 | Cell Commun. Signal 2016 |
| KN204922 | Cal27 | Oncotarget 2017 |
| KN210866 | DU145 | Anal. Biochem. 2017 |
| KN214877 | GLC82 | Oncotarget 2017 |
| KN206187 | Hela | J. Cell Biol. 2016 |
| KN200700 | HEp-2 | Proc. Natl. Acad. Sci. U.S.A. May 2016 |
| KN210866 | MCF10A | Anal. Biochem. 2017 |
| KN210866 | MDA-MB-231 | Anal. Biochem. 2017 |
| KN202627 | MG63 | DNA Cell Biol 2017 |
| KN204066 | PANC-1 | Am J Physiol Gastrointest Liver Physiol. 2016 |
| KN206029 | SaOs-2 | Sci Rep May 2016 |
| KN216220 | SH-SY5Y | J. Biol. Chem. 2016 |
| KN209079 | T84 | Oncotarget 2017 |
| KN210866 | U2OS | Anal. Biochem. 2017 |
2. CRISPR Vectors
| Vector Type | SKU | Name |
| All-in-One
CRISPR/Cas9 vectors |
GE100002 | pCas-Guide |
| GE100018 | pCas-Guide-EF1a-GFP | |
| GE100140 | pCas-Guide-EF1a-RFP | |
| GE100022 | pCas-Guide-EF1a-CD4 | |
| GE100010 | pLenti-Cas-Guide | |
| GE100045 | pLenti-EF1a-Cas-Guide | |
| GE100003 | pCas-Scramble | |
| GE100021 | pCas-Scramble-EF1a-GFP | |
| gRNA only vectors | GE100042 | pGuide |
| GE100044 | pGuide-EF1a-GFP | |
| GE100032 | pLenti-Guide-Puro | |
| Cas9 only vectors | GE100037 | pAAVS1-Cas9-Puro-DNR |
| GE100039 | pAAVS1-Cas9-BSD-DNR | |
| GE100028 | pLenti-Cas9 | |
| GE100029 | pLenti-Cas9-IRES-Puro | |
| GE100030 | pLenti-EF1a-Cas9-IRES-Puro | |
| GE100031 | pLenti-Cas9-P2A-tGFP | |
| GE100075 | pLenti-Cas9-Myc-DDK-P2A-Puro | |
| GE100076 | pLenti-Cas9-mGFP-P2A-Puro | |
| CRISPR/Cas9
T7 vectors |
GE100025 | pT7-Guide-IVT |
| GE100014 | pT7-Cas9 | |
| Cas9 Nickase | GE100019 | pCas-Guide-Nickase (H840A) |
| GE100062 | pCas-Guide-Nickase (D10A) | |
| GE100020 | pT7-Cas9-Nickase (D10A) | |
| Cas9 Dead Mutant | GE100061 | pCas-Guide-Nickase (D10A, H840A) |
| xCas9 Mutant | GE100078 | p-xCas9-Guide |
| Accessories | GE100007 | Annealing Buffer |
| GE100008 | CF3 Primer | |
| GE100017 | pCMV6-Entry-Cre |
3. CRISPRa and CRISPRi
| Catalog No. | Product Type | Description |
| GE100055 | CRISPRa Vector | pCas-Guide-CRISPRa vector, CRISPRa SAM activation vector containing dCas9-VP64 and gRNA(MS2) cloning site |
| GE100074 | pCas-Guide-GFP-CRISPRa gene activation vector containing dCas9-VP64 and tGFP reporter gene for gRNA cloning | |
| GE100081 | pCas-Guide-Puro-CRISPRa Vector, All-in-one Vector for CRISPR/Cas9 Gene activation with Puro selection marker, dCas9-VP64 and gRNA cloning site. | |
| GE100056 | Enhancer vector | pCRISPRa-Enhancer vector, expressing MS2-p65-HSF1, which synergistically activates gene expression with dCas9-VP64. |
| GE100058 | Scramble Control | pCas-Guide-CRISPRa-Scramble, scramble gRNA control in GE100055 vector (no selection marker/reporter) |
| GE100077 | pCas-Guide-GFP-CRISPRa-Scramble, scramble gRNA control in GE100074 vector (with tGFP) | |
| GE100082 | pCas-Guide-Puro-CRISPRa-Scramble, scramble gRNA control in GE100081 vector (with Puro selection) | |
| GE100057 | CRISPRa vector Kit | CRISPRa SAM vector kit containing pCas-Guide-CRISPRa (GE100055), pCRISPRa-Enhancer (GE100056) and pCas-Guide-CRISPRa-Scramble (GE100058) |
4. Functional CAS9 Protein
| SKU | Description | Size |
| TP790148 | CAS9 S. pyogenes Recombinant Protein | 500 pmol |
| TP790151 | CAS9-D10A S. pyogenes Recombinant Protein | 500 pmol |
| GE100053 | Cas9 in vitro digestion buffer, 10x | 0.2 ml |
5. Transgene Knockin via CRISPR at AAVS1 and ROSA26 Loci
| Type | Catalog | Product Name | Description |
| AAVS1 gRNA Vector | GE100023 | pCas-Guide-AAVS1 | AAVS1 gRNA vector, validated AAVS1 targeting sequence cloned in pCas-Guide vector |
| AAVS1 Donor Vectors | GE100024 | pAAVS1-Puro-DNR | Donor vector with AAVS1 homologous arms cloned, ready for transgene cloning |
| GE100035 | pAAVS1-BSD-DNR | Donor vector with AAVS1 homologous arms cloned (blasticidin selection), ready for exogenous gene cloning (10 ug) | |
| GE100046 | pAAVS1-EF1a-Puro-DNR | AAVS1 donor vector with AAVS1 homologous arms cloned (Puro selection), EF1a promoter, ready for exogenous gene cloning (10 ug) | |
| GE100048 | pAAVS1-EF1a-BSD-DNR | AAVS1 donor vector with AAVS1 homologous arms cloned (blasticidin selection), EF1a promoter, ready for exogenous gene cloning (10 ug) | |
| Transgene Knockin Vector Kits | GE100027 | AAVS1 Transgene knockin vector kit | Vector kit for targeted transgene insertion into AAVS1 locus, including GE100023, GE100024 and GE100003 |
| GE100036 | AAVS1 Transgene knockin kit (BSD) | Vector kit for targeted transgene insertion into AAVS1 locus (blasticidin selection), including GE100023, GE100035 and GE100003 | |
| GE100047 | AAVS1 Transgene Knockin kit (EF1a, Puro) | Vector kit for targeted transgene insertion into AAVS1 locus (EF1a, Puro), including GE100023, GE100046 and GE100003 | |
| GE100049 | AAVS1 Transgene Knockin kit (EF1a, BSD) | Vector kit for targeted transgene insertion into AAVS1 locus (EF1a, blasticidin), including GE100023, GE100048 and GE100003 | |
| Promoter | |||
| AAVS1 Donor Controls | GE100037 | pAAVS1-Cas9-Puro-DNR | CMV |
| GE100039 | pAAVS1-Cas9-BSD-DNR | CMV | |
| GE100026 | pAAVS1-RFP-DNR | CMV | |
| GE100063 | pAAVS1-mGFP-Puro-DNR | CMV | |
| GE100064 | pAAVS1-mRFP-Puro-DNR | CMV | |
| GE100065 | pAAVS1-mGFP-BSD-DNR | CMV | |
| GE100066 | pAAVS1-mRFP-BSD-DNR | CMV | |
| GE100068 | pAAVS1-EF1a-tGFP-puro-DNR | EF1a | |
| GE100069 | pAAVS1-EF1a-tGFP-BSD-DNR | EF1a | |
| GE100070 | pAAVS1-EF1a-tRFP-puro-DNR | EF1a | |
| GE100071 | pAAVS1-EF1a-tRFP-BSD-DNR | EF1a | |
| GE100072 | pAAVS1-EF1a-Luc-puro-DNR | EF1a | |
| GE100073 | pAAVS1-EF1a-Luc-BSD-DNR | EF1a |
Studi Kasus Produk Cyagen
Cyagen menawarkan layanan custom knock-out dan knock-in, khususnya untuk pembuatan model hewan transgenik yang relevan dengan studi penyakit. Mereka menyediakan berbagai layanan, termasuk pembuatan knock-out dan knock-in model, serta modifikasi genetik pada sel dan organoid.Penggunaan CRISPR dalam pembuatan model tikus transgenik telah mempercepat riset biomedis.
1. CRISPR Knockout Mice
Cyagen menyediakan layanan pembuatan model knockout menggunakan teknologi CRISPR/Cas9. Model knockout ini dibuat dengan menghilangkan gen tertentu pada tikus untuk mempelajari fungsi gen tersebut.
2. CRISPR Point Mutation Mice
Layanan berikutnya adalah pembuatan model tikus dengan mutasi titik (point mutation) pada gen target. Dengan teknologi CRISPR/Cas9, mutasi titik ini memungkinkan penyesuaian gen secara spesifik.
3. CRISPR Knockin Mice (ROSA26)
Cyagen juga menawarkan layanan pembuatan model knockin, terutama pada lokasi gen populer seperti ROSA26. Pada layanan ini, fragmen genetik hingga 15 kb dapat disisipkan pada lokus target, memungkinkan studi fungsi gen yang lebih kompleks.
4. CRISPR Conditional Knockout (cKO) Mice
Untuk kebutuhan penelitian yang lebih spesifik, Cyagen menyediakan layanan pembuatan model conditional knockout (cKO). Model ini memungkinkan penghapusan gen secara selektif di jaringan tertentu dengan sistem Cre-LoxP.
5. CRISPR Humanized Mouse Models
Terakhir, Cyagen menawarkan pembuatan model tikus humanized, yaitu tikus yang memiliki gen manusia disisipkan untuk studi penyakit yang lebih relevan dengan manusia.
Untuk pertanyaan produk dan stock lebih lanjut Bapak/Ibu dapat menghubungi kami PT. Indogen melalui email sales.indogen@gmail.com atau melalui WhatsApp berikut untuk fast respon +6281293185185.
Referensi :
Doudna, J. A., & Charpentier, E. (2014). The new frontier of genome engineering with CRISPR-Cas9. Science, 346(6213), 1258096. https://doi.org/10.1126/science.1258096
Engler, C., Gruetzner, R., Kandzia, R., & Marillonnet, S. (2009). Golden gate shuffling: a one-pot DNA shuffling method based on type IIs restriction enzymes. PLoS One, 4(5), e5553. https://doi.org/10.1371/journal.pone.0005553
Gibson, D. G., Young, L., Chuang, R. Y., Venter, J. C., Hutchison, C. A., & Smith, H. O. (2009). Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods, 6(5), 343–345. https://doi.org/10.1038/nmeth.1318
Gnudi, L., Long, D. A., editors. (2020). Diabetic Nephropathy: Methods and Protocols. Humana. https://doi.org/10.1007/978-1-4939-9841-8_20
Jinek, M., Chylinski, K., Fonfara, I., Hauer, M., Doudna, J. A., & Charpentier, E. (2012). A programmable dual-RNA–guided DNA endonuclease in adaptive bacterial immunity. Science, 337(6096), 816–821. https://doi.org/10.1126/science.1225829
Ran, F. A., Hsu, P. D., Wright, J., Agarwala, V., Scott, D. A., & Zhang, F. (2013). Genome engineering using the CRISPR-Cas9 system. Nature Protocols, 8(11), 2281–2308. https://doi.org/10.1038/nprot.2013.143
Sambrook, J., & Russell, D. W. (2001). Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory Press.
Wang, J.-W., Wang, A., Li, K., Wang, B., Jin, S., Reiser, M., & Lockey, R. F. (2015). CRISPR/Cas9 nuclease cleavage combined with Gibson assembly for seamless cloning. BioTechniques, 58(4), 161–170. https://doi.org/10.2144/000114261
Zhang, L., et al. (2021). CRISPR-Cas9 mediated gene editing in cancer research. Cancer Research, 81(15), 4054-4062. https://doi.org/10.1158/0008-5472.CAN-20-3523
Zhang, Y., Malzahn, A. A., Sretenovic, S., & Qi, Y. (2020). The emerging and uncultivated potential of CRISPR technology in agriculture. Nature Plants, 6(8), 823–832. https://doi.org/10.1038/s41477-020-0697-1
Artikel Terkait
- https://indogen.id/komponen-qpcr-dalam-genotyping-dan-metode-genotyping-pcr
- https://indogen.id/prosedur-cloning-cdna-dan-viral-gene-delivery-dari-brand-origene/
- https://indogen.id/cyagen/
- https://indogen.id/riset-stem-cell-model-penyakit-dan-aplikasi-klinis/
- https://indogen.id/cell-signaling-and-protein-biology/

