Workshop Laboratorium FK-KMK UGM: Analisis Sel T Regulatory (T-reg) dari Sampel PBMC dengan Flow Cytometry
Pelaksanaan workshop laboratorium dengan judul “Analisis Sel T Regulatory (T-reg) dari Sampel PBMC dengan Flow Cytometry” diselenggarakan pada Senin, 22 April 2024, di Laboratorium Riset Terpadu (LRT) Fakultas Kedokteran, Kesehatan Masyarakat, dan Keperawatan (FK-KMK) UGM, Yogyakarta. Kegiatan workshop disponsori oleh PT Indogen Intertama dan Elabscience Bionovation Inc. dengan kehadiran tiga representatif dari Elabscience Bionovation Inc.
Berikut alur rangkaian kegiatan workshop Flow Cytometry di FK-KMK UGM secara kronologis:
- Pembukaan oleh Panitia Acara
- Presentasi 1: Ibu Dewi Kartikawati Paramita, S.Si., M.Si., Ph.D
- Koleksi sampel darah perifer peserta
- Preparasi reagen dan darah untuk isolasi PBMC
- Presentasi 2: PT Indogen Intertama
- Koleksi limfosit dan pencucian
- Perhitungan sel secara otomatis
- Presentasi 3: Elabscience Bionovation Inc.
- Istirahat
- Staining permukaan sel dan blocking
- Gating, isolasi dan operasi flow-cytometer
- Validasi hasil pembacaan
- Analisis data (oleh Elabscience Bionovation Inc.)
- Penutupan oleh Panitia Acara
A. Koleksi Darah Tepi dan Preparasi Darah
1. Pengumpulan 2 mL darah dengan antikoagulasi heparin. Media RPMI atau saline fisiologis (PBS) ditambahkan dengan perbandingan 1:1 hingga total volume 4 mL.

Gambar-1.-Koleksi-darah-peserta-oleh-panitia
2. Sebanyak 4 mL Ficoll (larutan pemisahan limfosit) ditambahkan ke dalam tabung 15 mL.
3. Campuran darah-RPMI sebanyak 4 mL dimasukkan ke dalam tabung 15 mL melalui dinding tabung secara perlahan untuk memastikan darah tidak tercampur dan berada di atas permukaan larutan Ficoll.

Gambar 2. Transfer campuran darah-RPMI di atas Ficoll.
4. Catatan: penambahan secara cepat akan mencampurkan darah dengan Ficoll..
5. Sentrifugasi tabung pada 400xg selama 25 menit di RT. Setelah sentrifugasi, tabung diinkubasi atau didiamkan selama 20-30 menit hingga terbentuk lapisan (prinsip sentrifugasi gradien densitas).

Gambar 3. Sentrifugasi gradien densitas untuk separasi sel-sel
6. Catatan: kondisi sentrifugasi harus sesuai untuk sampel darah dan disarankan untuk mengetahui persyaratan kondisi pemisahan segera sebelum percobaan.
B. Koleksi, Pencucian dan Penghitungan Limfosit
1. Darah dalam tabung akan terbagi menjadi 4 lapisan;
2. lapisan atas: plasma,
3. lapisan kedua: limfosit putih,
4. lapisan ketiga: larutan pemisah transparan, dan
5. lapisan bawah: eritrosit.
- Buang atau hilangkan lapisan plasma tanpa mengganggu lapisan kedua.
- Aspirasi lapisan kedua (limfosit) dengan hati-hati ke dalam tabung 15 mL baru.
Gambar-4.-Aspirasi-limfosit-pada-lapisan-kedua
- Sel yang diperoleh kemudian dicuci dengan Cell Staining Buffer (atau PBS 0,1% BSA) dengan sentrifugasi pada 300xg selama 5 menit di RT. Koleksi trombosit (platelet) dan buang supernatan.
- Lisis eritrosit (opsional): Resuspensi dengan Cell Staining Buffer (atau PBS 0,1% BSA) dan dengan menjentikkan tabung secara perlahan. RBC Lysis Buffer ditambahkan per 1 mL suspensi PBMC dan dicampur dengan perlahan. Inkubasi selama 5 menit kemudian Cell Staining Buffer (atau PBS 0,1% BSA) ditambahkan dan sentrifugas padai 400xg selama 5 menit di RT.
- Koleksi trombosit dan buang supernatan.
- Resuspensi dengan Cell Staining Buffer (atau PBS 0,1% BSA) dengan menjentikkan tabung secara perlahan.
- Cuci kembali sel dengan Cell Staining Buffer (atau PBS 0,1% BSA) dengan sentrifugasi pada 300xg selama 5 menit di RT.
- Koleksi trombosit dan buang supernatan.
- Catatan: saat mengisolasi sampel darah dengan aliquot atau pengulangan, gabungkan semua suspensi sel individual dari sampel yang sama ke dalam satu tabung.
- Siapkan dan encerkan larutan Trypan blue dengan PBS.
- Campurkan sunsensi sel dengan Trypan blue dengan perbandingan 1:1.
- Letakkan setetes pada Counting Slide, tutupi dengan Coverslip dan hitung dengan Automatic Cell Counter.

Gambar 5. Perhitungan sel secara otomatis
- Hasil print-out data jumlah sel total dan persentase sel viabel (jumlah sel/mL).
- Jumlah sel relatif aktual dengan mengalikan pengenceran Trypan blue.
C. Staining dan Blocking Permukaan Sel
Panel dasar antibodi FCM yang digunakan dalam kegiatan workshop ini menggunakan panel standar dengan target CD127 yang didesain oleh Elabscience Bionovation Inc., sebagai berikut:
- E-AB-F1352C – FITC Anti-Human CD4 Antibody[SK3]
- E-AB-F1194D – PE Anti-Human CD25 Antibody[BC96]
- E-AB-F1152E – APC Anti-Human CD127_IL-7RA Antibody[A019D5]
- E-AB-F09792D – PE Mouse IgG1, κ Isotype Control[MOPC-21] – Kontrol isotipe
- E-AB-F1236A – Purified Anti-Human CD16 Antibody[3G8] – Fcr Blocker
- Kit Antibodi-Fluofor dengan grade flow cytometry (FCM) berasal Elabscience dengan ukuran setiap kit vial sebanyak 100 reaksi.
- Sebelum membuka vial antibodi, vial perlu disentrifugasi untuk memulihkan konten antibodi secara merata.
- Jumlah reagen yang direkomendasi untuk digunakan adalah 5 µL antibodi per reaksi (juta sel dalam 100 µL volume pewarnaan atau per 100 µL whole blood).
- Catatan: lakukan optimasi pengenceran untuk menentukan pengenceran optimal dikarenakan aplikasi bervariasi.
Memblokir reseptor Fc dapat mengurangi staining imunofluoresen nonspesifik. Reseptor Fc ini umumnya dapat ditemukan pada monosit, makrofag, sel dendritik, dan sel B.
- Sel Manusia dan Tikus: Sel pra-inkubasi dengan kelebihan purified Ig tidak relevan dari spesies sama dan isotipe sama dengan antibodi yang digunakan untuk staining imunofluoresen atau serum dari spesies sama dengan antibodi yang digunakan.
- Sel Mencit: purified Antibodi Anti-Mouse CD16/CD32 khusus untuk FcγR III/II dapat digunakan untuk memblokir staining antibodi non-spesifik. Jadi blok reseptor Fc dengan melakukan pre-inkubasi sel dengan 0,5-1 µg Anti-Mouse CD16/CD32 dalam volume 100 µL selama 10 menit pada RT.
Staining Permukaan Sel:
- Staining sel dengan panel antibodi yang telah disiapkan dan masukkan juga kontrol isotipe yang sesuai dengan kebutuhan.
- Penambahan antibodi sesuai dengan konsentrasi yang direkomendasikan dan campurkan secara merata.
- Inkubasi pada suhu 4°C selama 30 menit dalam tempat gelap.
D. Gating, Isolasi dan Validasi T-reg
- Kontrol kompensasi disiapkan terlebih dahulu, kemudian kumpulkan setidaknya 104 events untuk masing-masing sampel.
- Catatan: Kompensasi fluoresensi adalah proses mengoreksi limpahan fluoresensi dengan cara menghilangkan sinyal dari setiap fluorokrom dari semua detektor kecuali yang dikhususkan untuk mengukur fluorokrom tertentu. (Flow-cytometer modern memungkinkan untuk mengubah setting kompensasi setelah data diperoleh).
Gambar-6.-Analisis-sel-menggunakan-platform-BD-FACSAria™-III-Cell-Sorter
- Lakukan gating pada sel T CD4+.
- Catatan: Strategi gating adalah pengelompokan atau pembatasan sel berdasarkan karakteristik yang sama dengan wilayah spesifik untuk membedakan populasi sel dalam sampel heterogen.
- Pada populasi CD4+, lakukan gating untuk sel CD25+.
- Keluarkan sel CD127+ dari sel non-Treg.
- Hasil berupa plot dan jumlah events (sel).
- Flow-cytometer dengan kemampuan sorting akan secara otomatis melakukan isolasi murni untuk target sel berdasarkan hasil data analisis. Fluorescence-Activated Cell Sorting (FACS) dimana flow-cytometer mendeteksi sinyal fluoresensi pada sel dan sel disortir berdasarkan intensitas fluoresensi.
- Isolat sel T-reg kemudian dapat dikoleksi untuk digunakan untuk percobaan selanjutnya.
- Perhatian: Strategi gating untuk CD4/25/127 pada PBMC dirancang untuk menghilangkan artefak karena ketidakstabilan fluida dan sel doublet, setelah itu sel-sel mati dieksklusikan. Setelah gaying sel T CD4+ menggunakan parameter ukuran [SSC dan FSC], gating Treg CD25/127 dapat dilakukan.
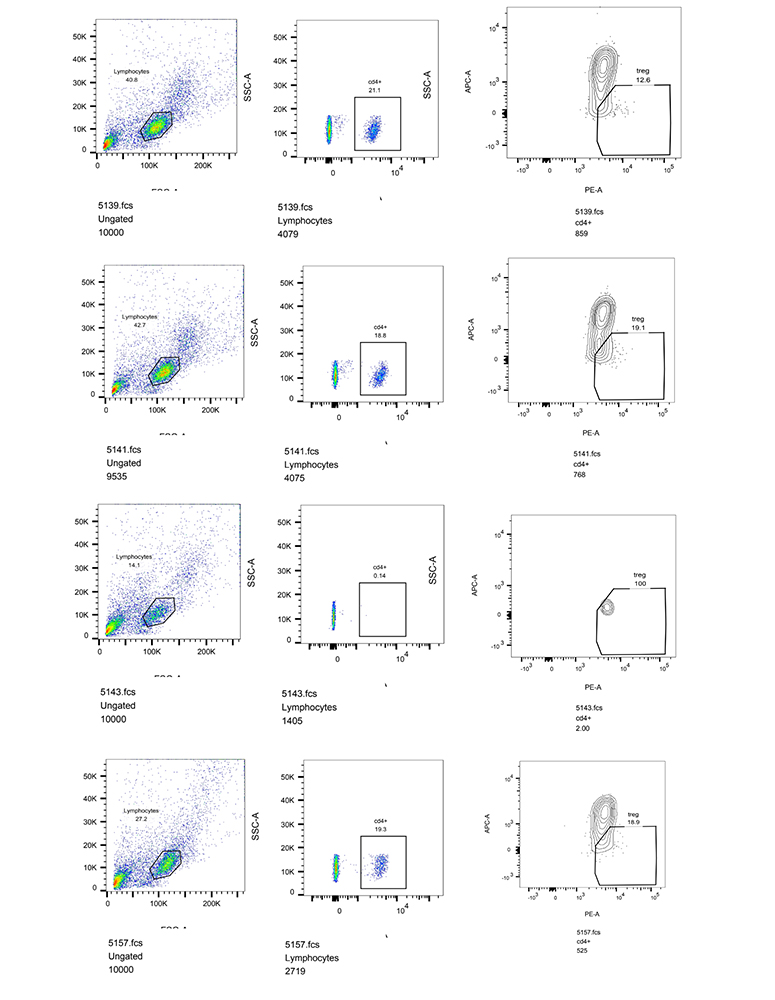
Gambar-7.-Hasil-analisis-sel-oleh-Elabscience-Bionovation-Inc
E. Q&A Workshop
1. Apakah spesimen atau sampel FFPE dapat digunakan untuk Flow Cytometry?
Jawaban: Untuk spesimen yang digunakan pada Flow Cytometry (FCM) yaitu spesimesn partikel tunggal atau sel tunggall, sedangkan untuk FFPE telah dilakukan fiksasi dan parafinasi, sehingga probabilitas perubahan struktur protein juga ada. Antibodi IHC/IF secara umum merupakan antibodi yang didesain untuk perubahan struktur tersebut, sedangkan untuk antibodi FCM didesain khusus target sel viable.
2. Apakah antibodi FCM untuk Human dapat digunakan untuk species lainnya?
Jawaban: Beberapa kasus mungkin tidak menimbulkan masalah. Namun perlu diperhatikan bahwa antibodi ini belum tervalidasi oleh Quality Control sehingga hasil sesuai atau tidak sepenuhnya dibebankan kepada user. Selain itu, credit memo (replacement/refund) tidak dapat dilakukan proses karena prosedur yang dilakukan tidak sesuai dengan rekomendasi Manufaktur.
3. Apakah perbedaan PBS, PBS + 0.1 BSA dan Cell Staining Buffer untuk proses pengenceran, washing dan resuspensi sel?
Jawaban: Cell Staining Buffer mengandung PBS, BSA dan EDTA. BSA berperan untuk mengurangi pengikatan non-spesifik antibodi fluoresen dan mengurangi kerusakan sel. EDTA akan berperan untuk disosiasi antara sel-sel adheren dengan mengikat ion logam. Sehingga dibandingkan keduanya, Cell Staining Buffer telah termoptimasi untuk metode FCM.
4. Dapatkah antibodi flowcytometry Elabscience digunakan untuk sampel darah atau spesimen yang berasal dari kucing dan anjing?
Jawaban: saat ini untuk reaktivitas antibodi masih untuk spesies Human, Rat, Mouse, Goat (terbatas) dan Rabbit (terbatas). Secara umum untuk Produsen lainnya juga tidak memiliki antibodi monoklonal primer terkonjugasi dye fluorescens,
Namun berikut terdapat 2 cara alternatif lain:
- Menggunakan antibodi primer yang tervalidasi reaktivitasnya kepada kucing atau anjing, atau juga reaktivitas universal (all species). Kemudian pendeteksian sinyal dapat digunakan dengan antibodi sekunder terkonjugasi dye fluorescence kemudian baru dapat dilakukan running Flow Cytometry untuk sampel. Lihat produk antibodi sekunder – dye fluorescence.
- Menggunakan antibodi primer yang tervalidasi reaktivitasnya kepada kucing atau anjing, atau juga reaktivitas universal (all species). Kemudian di-label dengan Fluorescent Dye Labelling Kit untuk antibodi primer tersebut. Lihat produk labeling kit.
- Antibodi primer reaktif kucing, anjing atau universal dapat ditanyakan kepada kami PT Indogen Intertama untuk dapat kami rekomendasikan produk dari produsen lainnya.
5. Apakah data analisis dilakukan untuk data yang diperoleh?
Jawab: Benar, analisis data dapat dilakukan dari hasil yang diperoleh dari flow-cytometer, namun karena kompleksitasnya, keahlian atau skill bioinformatika, analisis flowcytometry dan program khusus. Elabscience menawarkan jasa Data Analisis FCM untuk penggunaan antibodi FCM mereka. Data FCM dapat dikirimkan kepada kami, PT Indogen Intertama, untuk dapat diajukkan untuk dianalisis.
6. Apakah Elabscience menawarkan jasa pembuatan panel design untuk matching antibodi dan dye fluorescens?
Jawaban: Benar, jasa desain panel FCM antibodi juga ditawarkan oleh Elabscience untuk spesifitas dan personalisasi penelitian yang dibutuhkan. Informasi target atau jenis sel apa yang akan dilakukan, dapat menghubungi ke kami untuk dapat kami ajukkan ke Elabsceince Support.
7. Perbedaan Isotype Control, Negative Control, Positive Control dan FMO?
Jawaban:
- Antibodi Isotype Control: antibodi terhadap antigen non-target pada populasi sel yang sedang dianalisis. Tidak memiliki kemampuan untuk mengikat antigen target. Kontrol isotipe berfungsi sebagai “kontrol negatif” untuk menunjukkan bahwa setiap reaksi yang diamati memang disebabkan oleh interaksi sebenarnya antara epitop antigen dan antibodi primer. Dapat menentukan kadar “fluoresensi background” oleh pengikatan antibodi non-spesifik. Perhatian: tidak boleh digunakan untuk membedakan sel positif dari sel negatif, atau menetapkan daerah gating positif.
- Kontrol Negatif: digunakan untuk menilai “pengikatan non-spesifik” dan “background noise”. Contoh: isotype control dan secondary antibody-only controls. Memastikan bahwa sinyal yang diamati spesifik dan mengurangi risiko “false positive”.
- Kontrol Positif: digunakan untuk memvalidasi kinerja pengujian dengan kadar antigen target yang diketahui.
- Fluorescence Minus One (FMO) Control: kontrol negatif khusus yang digunakan dalam FCM. Dengan staining sel dengan semua antibodi kecuali satu antibodi serta antibodi yang dihilangkan diganti dengan Isotype Control. Menentukan “fluorescence baseline” untuk setiap channel, memungkinkan gating akurat dan meminimalkan “false positive”. Fungsi dalam regulasi gating dan menilai “fluorescence spillover”.

