Workshop: Pelatihan Genomic Assay I – Real Time PCR di Fakultas Kedokteran Gigi Universitas Indonesia
Fakultas Kedokteran Gigi Universitas Indonesia rutin mengadakan Workshop atau Pelatihan setiap tahunnya agar peneliti kedokteran gigi memiliki pemahaman terhadap dasar-dasar pengerjaan di laboratorium dan mampu secara mandiri membuat rancangan penelitian serta melakukan uji laboratorium dengan benar sesuai dengan tujuan penelitiannya. Berjalannya workshop ini, PT. INDOGEN INTERTAMA turut serta dalam acara tersebut.

Gambar 1. Workshop Pelatihan Genomic Assay I – Real Time PCR di FKGUI
A. Waktu dan Tempat Pelaksanaan Workshop Genomic Assay I
Waktu : 17 – 18 Juli 2024
Bertempat : Laboratorium Oral Biologi – Fakultas Kedokteran Gigi Universitas Indonesia, Jl. Salemba Raya Jl. Salemba Raya IV No.2, RT.2/RW.5, Kenari, Kec. Senen, Kota Jakarta Pusat, Daerah Khusus Ibukota Jakarta 10430
B. Penyampaian Materi
| No. | Materi | Narasumber |
| 1. | Prinsip dan Pengambilan Spesimen Penelitian | Prof. drg. Dewi Fatma Suniarti Sastradipura, M.S., Ph.D., PBO |
| 2. | Real Time PCR | Dr. drg. Lisa Rinanda Amir, PBO |
| 3. | Analisis Data RT-PCR | drg. Erik Idrus, Ph.D |
1. Prinsip dan Pengambilan Spesimen

Gambar 2. Penyampaian Materi oleh Prof. drg. Dewi Fatma S Sastradipura, M.S., Ph.D., PBO
Poin penting dalam Pengambilan Spesimen Penelitian diantaranya:
- Pastikan jenis sampel apa yang ingin diuji: serum, jaringan, atau saliva tentukan waktu pengambilan
- Persiapkan Subjek penelitian:
- Persiapan subjek: harus legal
- Koleksi spesimen: Tentukan berdasarkan general guideline for blood collection and processing. Contoh:
Koleksi Jaringan: catat sumber jaringan (biopsy, operasi, autopsy), waktu harus sesingkat mungkin (1-2 jam), freezing secepat mungkin dapada medium freezing (precooles isopentane)
Koleksi saliva: saliva dan sel merupakan sumber DNA yang baik, diperoleh dg swab, cryo brush, atau berkumur,oragene salah satu pengawet untuk sampel saliva pada RT. - Pembuangan sampel sisa: harus buang dengan aturan yg baik, tidak dapat sembarang.
2. Real Time PCR

Gambar 3. Penyampaian Materi oleh Dr. drg. Lisa Rinanda Amir, PBO
Prinsip dasar Real Time PCR
Pada dasarnya Real time PCR merupakan teknik perbanyakan gen target dari sampel sedikit. Prosesnya dimulai dengan denaturasi mengubah double strain DNA menjadi single strain kemudian dengan penambahan primer target dan mastermix single strain tadi akan saling menempel dan terjadi perbanyakan (dNTP). Peningkatan sinyal fluorescent berbanding lurus dengan jumlah produk PCR (amplicons) yang dihasilkan pada reaksi PCR
Proses dalam Real Time PCR:
1. Denaturasi
Proses ini Memisahkan dsDNA – ssDNA. Temperatur tertinggi DNA polimerase masih dapat bertahan. Waktu denaturasi dapat diperpanjang apabila sample mengandung banyak GC content.
2. Annealing
Hibridisasi sekuen komplimenter. Temperatur maksimal dari fase annealing berdasarkan Tm primer (5℃ <™ primer).
3. Extension
Proses ini dilakukan pada suhu 70-72℃, Temperatur optimal DNA polimerase. Ekstension berlangsung 100 bp per detik.
Keunggulan menggunakan teknik RT-PCR, tidak membutuhkan analisis tambahan setelah selesai RT-PCR seperti gel elektroforesis.
Jumlah DNA diukur dengan bahan kimia dapat berupa fluorescent dyes seperti SYBR green, atau DNA probe TaqMan. Biasanya penggunaan TaqMan untuk mendeteksi gen lebih spesifik dan harga relatif lebih tinggi dibandingkan SYBR Green. Salah satu produk kami yang digunakan pada Pelatihan ini yaitu SolarBio Cat. SR1110 – 2×SYBR Green PCR Mastermix. Adapun produk Taqman yang kami suplai yaitu diantaranya sebagai berikut.
Tabel 1. Produk DNA Probe dari Brand SolarBio
| Brand | Catalog | Deskripsi | Jumlah test |
| SolarBio | T2210 | TaqMan One Step RT-qPCR Kit | 50T, 200T |
| SolarBio | SR2110 | 2×Taqman PCR MasterMix | 50T, 200T |
| SolarBio | SR2111 | 2×Taqman PCR MasterMix (containing UNG enzyme) | 50T, 200T |
Perbedaan Real Time PCR One step dan Two Step
| Perbedaan | One Step RT-PCR | Two Step RT-PCR |
| Deskripsi | Reverse transcriptase dan RT PCR dilakukan sekali running. dipilih apabila Kita memiliki jumlah sampel (DNA template) yang banyak, dan target
gen yang akan dievaluasi jumlahnya sedikit). |
Reverse transcriptase dan RT PCR dilakukan 2 tahap terpisah. Dapat digunakan untuk sampel yang sedikit
|
| Keunggulan | – Variasi eksperimen lebih sedikit karena reaksi pada tabung yang sama – Tahapan pipet lebih sedikitmengurangi risiko kontaminasi- Cocok untuk tahapan skrining- Lebih cepat |
– cDNA yang stabil dapat disimpan dalam waktu lama dan digunakan untuk berbagai reaksi
– Target gen dan gen referensi dapat diamplifikasi dari cDNA yang sama
|
| Kekurangan | – Tidak dapat optimasi 2 reaksi dengan terpisah
– Kurang sensitif dibandingkan 2-step karena kondisi reaksi merupakan kompromi dari kombinasi 2 reaksi – Deteksi target gen lebih sedikit dari 1 sampel |
– Menggunakan beberapa tubes dan tahapan pipetting
– Risiko kontaminasi DNA lebih besar – Waktu lebih lama
|
| Proses | 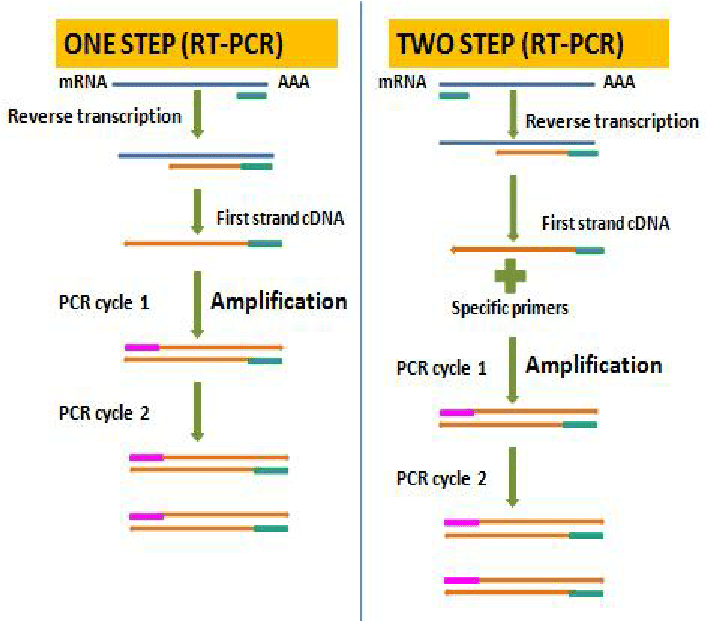 |
 |
Analisis Data RT-PCR
Standard Curve RT-PCR
Standard curve atau kurva standar dalam RT-PCR biasanya digunakan untuk Mengevaluasi efisiensi dari reaksi PCR dan berkaitan dengan pengenceran sampel yang akan diuji. Kurva terbentuk dengan plot linear dengan correlation coefficient (R2) maksimal 0.99.
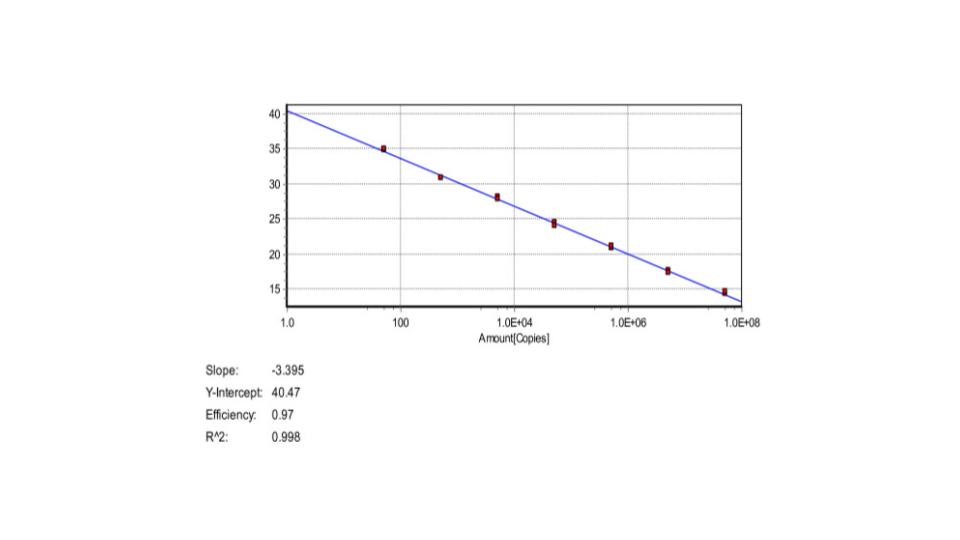
Gambar 4. Kurva Standar RT-PCR. X-axis menunjukan jumlah copy DNA dan Y-axis merupakan jumlah siklus threshold / CT (Threshold Cycle).
Nilai efficiency pada kurva menunjukan doubling template DNA pada setiap siklus termal pada fase exponensial. Adapun Slope Untuk mendapatkan hasil yang akurat dan reproducible. Idealnya reaksi pcr memiliki efisiensi sedekat mungkin dengan 100%, ekivalen dengan slope: -3.32.
CT (Cycle Threshold)
Nilai CT mewakili jumlah siklus di mana fluoresensi yang dihasilkan mencapai nilai tertentu. Ambang batas ini ditetapkan untuk menentukan kapan sejumlah besar DNA atau RNA target telah diamplifikasi. Digunakan untuk menghitung jumlah kopi DNA awal. CT Value dalam riset jika <35 harus diulang, semakin singkat maka ampliconnya semakin bagus.
Melt Curve
Analisis melting curve paska amplifikasi dilakukan untuk melihat spesifisitas primer (primer-dimer, atau secondary structure). Perubahan fluorescence ditemukan ketika dsDNA dengan molekul dye terdisosiasi/“melt” menjadi ssDNA ketika temperatur reaksi ditingkatkan. Misalnya dsDNA yang berikatan dengan molekul die Sybr Green dipanaskan — terjadi penurunan fluorescence ketika mencapai melting point (Tm) disosiasi strand DNA dengan penglepasan molekul dye. Primer spesifik muncul satu satu peak pada melt curve (Gambar 5.)
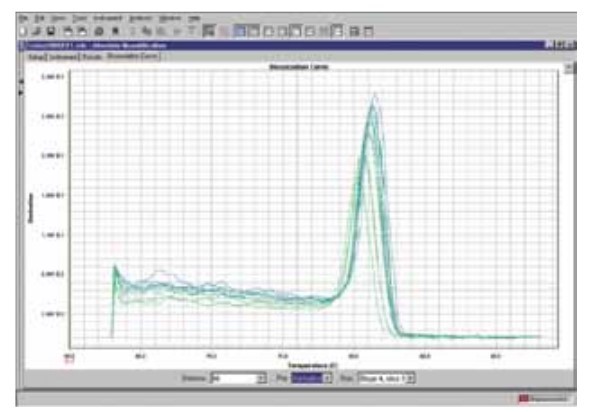
Gambar 5. Melt Curve
Kuantifikasi Analisa RT-PCR
Absolute Quantification
Hasil dari analisis absolute quantification adalah jumlah asam nukleat (jumlah kopi, µg) per jumlah sample (per sel, atau per total DNA). Sample akan terlihat pada range curva standard.
Relative Quantification
Relative quantification merupakan Perhitungan ekspresi gen pada suatu sample (misalnya dengan perlakuan) dan dibandingkan dengan ekspresi gen tersebut pada sampel lain (misalnya tanpa perlakukan). Adapun untuk gen tanpa perlakukan disebut juga sebagai Gen normalizer/housekeeping. Gen ini digunakan sebagai kontrol internal untuk variabilitas eksperimen pada tipe kuantifikasi ini (GAPDH, 18s, β-actin, β-2-microglobulin (B2M), β-glucuronidase (GUS), TATA-Box binding protein (TBP)). Hasilnya diekspresikan sebagai fold-change/fold different atau disebut juga dengan Normalized expression ratio (peningkatan atau penurunan) relative terhadap kelompok kontrol tanpa perlakuan.

Gambar 6. Rumus Relative Quantification
C. Tahapan Pengerjaan RT-PCR
Selain Materi yang telah disampaikan para Dosen dan Guru Besar Fakultas Kedokteran Gigi Universitas Indonesia, Departemen Oral Biologi para Peserta workshop juga berkesempatan untuk hand on langsung di laboratorium. Proses pengerjaan RT-PCR ini dilakukan dengan teknik 2-step RT-PCR. Adapun tahapan yang dilakukan dalam pemeriksaan ekspresi Gen dengan teknik RT-PCR ini yaitu:
1. Isolasi RNA
a. Preparasi sampel dan bahan
> Sampel berupa kultur sel eukariotik sekitar 500jt sel per 0.5ml (1 vial).
> Bahan isolasi RNA yang dibutuhkan berupa reagen Trizol sebanyak 0.5ml per vial dan chloroform sebanyak 0.1ml.
Trizol merupakan reagen konvensional dengan teknik manual dapat juga menggunakan Tripure reagen yang kami dapat sediakan dari brand AMTBio catalog ATB2700-50. Dengan menggunakan reagen ini akan didapat 3 tipe sampel secara bersamaan yaitu sampe RNA, DNA dan Protein. Adapun untuk isolasi spesifik hanya untuk mendapatkan sampel RNA dapat menggunakan kit esktrasi RNA yang lebih spesifik. Mengenai kit Ekstraksi RNA dapat klik disini.

Gambar 7. Isolasi RNA dengan Trizol
b. Pencampuran Sampel dan reagen
> Campurkan sampel dan reagent kedalam 1 vial/tube 1.5ml kemudian homogenisasi sehingga tercampur rata.
c. Sentrifugasi
> Lakukan sentrifugasi dengan kecepatan 12000 rpm selama 15 menit sehingga terbentuk fase separasi.

Gambar 8. Proses Sentrifugasi RNA
d. Pemisahan fase RNA / Aqueous
> Setelah sentrifugasi akan terjadi pemisahan 3 lapis fase, layer pertama merupakan fase aqueous dimana lapisan ini merupakan sampel RNA, layer kedua atau tengah merupakan sampel DNA dan yang terakhir yaitu layer paling bawah merupakan sampel Protein.

Gambar 9. Fase Separasi Isolasi RNA
> Pindahkan fase RNA ke dalam vial yang baru.
e. Lakukan Presipitasi sampel RNA menggunakan pelarut isopropanol.
2. Reverse Transcriptase
Pada tahap ini kebetulan untuk sampel sudah tersedia berupa cDNA. Tujuan dari proses reverse transkriptase mendapatkan fragmen cDNA yang dapat disimpan untuk pengujian selanjutnya sehingga efisien. Untuk proses ini dibutuhkan reagent atau kit seperti cDNA synthesis kit. INDOGEN dapat suplai kit cDNA ini dari brand ABP Bioscience dan SolarBio, berikut merupakan list produknya.
| Brand | Catalog | Deskripsi | Size |
| ABP Bioscience | D040 | iScript™ IV Reverse Transcriptase | 5,000 Unit
20,000 Unit |
| ABP Bioscience | D041 | iScript™ IV First-Strand cDNA Synthesis Kit | 25 rxn
100 rxn |
| SolarBio | RP1100 | Universal RT-PCR Kit(M-MLV) | 25 rxn
50 rxn 100 rxn |
| SolarBio | RP1105 | Universal RT-PCR Kit(M-MLV, free Taq polymerase) | 50 rxn
100 rxn |
| SolarBio | RP1200 | Universal RT-PCR Kit(AMV) | 50 rxn
100 rxn |
3. Menentukan Konsentrasi RNA
Setelah cDNA didapat, lakukan perhitungan konsentrasinya. Perhitungan konsentrasi cDNA menggunakan alat Qubit dengan reagen Qubit® dsDNA HS (High Sensitivity) Assay Kit. Setiap sampel dibaca dengan Qubit, dan akan didapatkan konsentrasinya, setelah itu lakukan standarisasi konsentrasi sampel mengacu pada konsentrasi sampel yang terkecil dengan cara melakukan pengenceran terhadap sampel menggunakan rumus C1 x V1 = C2 x V2.

Gambar 10. Proses Pengenceran cDNA
Asam nukleat memiliki absorban maksimum pada 260 nm. Ratio absorban maksimum (260 nm) terhadap absorban 280 nm digunakan untuk pengukuran konsentrasi DNA dan RNA. Selain menggunakan Qubit, konsentrasi asam nukleat juga dapat dilakukan dengan alat nano spectrophotometer tanpa perlu menambahkan reagent atau kit.
4. Proses RT-PCR / qPCR
Bahan dan Alat :
> Sampel cDNA dengan konsentrasi yang terstandar
> SYBR Green Mastermix
SYBR green yang digunakan menggunakan brand Solarbio Cat.SR1110 2×SYBR Green PCR Mastermix, adapun komponen yang terdapat didalamnya yaitu:
- 2×SYBR Green PCR Mastermix
- ROX Reference Dye І(50×)
- ROX Reference Dye ІI(100×)
- ddH2O
> Primer spesifik: GAPDH, IL-1β, Collagen-A (primer didilusi dengan TE buffer)
> 48-Well Reaction Plate
> 48-Well Optical Adhesive Film
> Mesin RT-PCR
Tahap pengerjaan
- Siapkan bahan dan sampel
- Buat pemetaan sampel pada 48 well plate
- Siapkan Mastermix yaitu campurkan primer forward dan reverse @0.75µL + SYBR green High Rox 7.5µL + nuclease free water (NFW) atau ddH2O 1µL jadi total per well sebanyak 10µL.
Gambar 11. Persiapan Mastermix RT-PCR
- Masukkan mastermix kedalam well dan tutup dengan Optical Adhesive Film.
- Sentrifugasi 48 well yang telah terisi sampel dengan kecepatan 2000 rpm selama 3 menit.
- Masukkan sampel ke dalam mesin RT-PCR yang sebelumnya telah disesuaikan suhunya, waktu dan pemilihan fluorochromnya.

Gambar 12. Proses running Sampel pada mesin RT-PCR
5. Analisis hasil RT-PCR
Hasil Running RT-PCR
Analisis hasil RT-PCR dijelaskan oleh drg. Erik Idrus, Ph.D

Gambar 13. Analisis Hasil RT-PCR oleh drg. Erik Idrus, Ph.D
Berikut merupakan hasil dari pengerjaan RT-PCR dalam workshop kali ini.
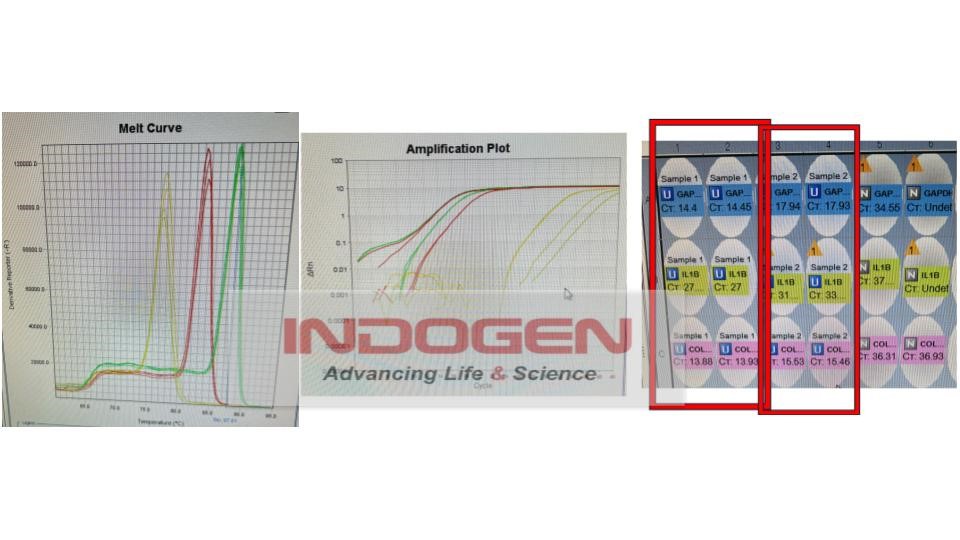
Gambar 14. Hasil running pada mesin RT-PCR
Analisa sampel Target gen IL-1β
Dari data diatas, didapatkan nilai CT masing-masing sampel dengan housekeeping gen dan target gen. Berikut nilai CT sampel terhadap target gen dan gen target IL-1β.
| Sampel | Housekeeping gen (GAPDH) | Gen target (IL-1β) | ||
| Well 1 | Well 2 | Well 1 | Well 2 | |
| Sampel 1 (kontrol) |
14.4 | 14.45 | 27 | 27 |
| Sampel 2 (perlakuan) |
17.94 | 17.93 | 31 | 33 |
Menghitung nilai rata-rata Ct untuk setiap gen pada setiap sampel yang diukur
| Sampel | Housekeeping gen (GAPDH) | Gen target (IL-1β) | ||||
| Well 1 | Well 2 | rata-rata | Well 1 | Well 2 | rata-rata | |
| Sampel 1 (kontrol) |
14.4 | 14.45 | 14.425 | 27 | 27 | 27 |
| Sampel 2 (perlakuan) |
17.94 | 17.93 | 17.935 | 31 | 33 | 32 |
Menghitung ΔCt (delta Ct) untuk setiap sampel dengan menggunakan nilai rata-rata Ct
| Sampel | Housekeeping gen (GAPDH) | Gen target (IL-1β) | ΔCt | ||||
| Well 1 | Well 2 | rata-rata | Well 1 | Well 2 | rata-rata | ||
| Sampel 1 (kontrol) |
14.4 | 14.45 | 14.425 | 27 | 27 | 27 | 12.575 |
| Sampel 2 (perlakuan) |
17.94 | 17.93 | 17.935 | 31 | 33 | 32 | 14.065 |
Menghitung ΔΔCt relatif terhadap rata-rata Kontrol ΔCt
ΔΔCt = ΔCt (perlakuan) – ΔCt (kontrol)
| Sampel | ΔCt | ΔΔCt |
| Sampel 1 (kontrol) |
12.575 | 0 |
| Sampel 2 (perlakuan) |
14.065 | 1.49 |
Menghitung Fold gene expression = 2^-(ΔΔCt)
| Sampel | ΔCt | ΔΔCt | 2^-(ΔΔCt) |
| Sampel 1 (kontrol) |
12.575 | 0 | 1 |
| Sampel 2 (perlakuan) |
14.065 | 1.49 | 0.356 |
Analisa sampel Target gen COL-A
Dari data diatas, didapatkan nilai CT masing-masing sampel dengan housekeeping gen dan target gen. Berikut nilai CT sampel terhadap target gen dan gen target COL-A.
| Sampel | Housekeeping gen (GAPDH) | Gen target (COL-A) | ||
| Well 1 | Well 2 | Well 1 | Well 2 | |
| Sampel 1 (kontrol) |
14.4 | 14.45 | 13.88 | 13.93 |
| Sampel 2 (perlakuan) |
17.94 | 17.93 | 15.53 | 15.46 |
Menghitung nilai rata-rata Ct untuk setiap gen pada setiap sampel yang diukur
| Sampel | Housekeeping gen (GAPDH) | Gen target (COL-A) | ||||
| Well 1 | Well 2 | rata-rata | Well 1 | Well 2 | rata-rata | |
| Sampel 1 (kontrol) |
14.4 | 14.45 | 14.425 | 13.88 | 13.93 | 13.905 |
| Sampel 2 (perlakuan) |
17.94 | 17.93 | 17.935 | 15.53 | 15.46 | 15.495 |
Menghitung ΔCt (delta Ct) untuk setiap sampel dengan menggunakan nilai rata-rata Ct
| Sampel | Housekeeping gen (GAPDH) | Gen target (COL-A) | ΔCt | ||||
| Well 1 | Well 2 | rata-rata | Well 1 | Well 2 | rata-rata | ||
| Sampel 1 (kontrol) |
14.4 | 14.45 | 14.425 | 13.88 | 13.93 | 13.905 | -0.52 |
| Sampel 2 (perlakuan) |
17.94 | 17.93 | 17.935 | 15.53 | 15.46 | 15.495 | -2.44 |
Menghitung ΔΔCt relatif terhadap rata-rata Kontrol ΔCt
ΔΔCt = ΔCt (perlakuan) – ΔCt (kontrol)
| Sampel | ΔCt | ΔΔCt |
| Sampel 1 (kontrol) |
-0.52 | 0 |
| Sampel 2 (perlakuan) |
-2.44 | -1.92 |
Menghitung Fold gene expression = 2^-(ΔΔCt)
| Sampel | ΔCt | ΔΔCt | 2^-(ΔΔCt) |
| Sampel 1 (kontrol) |
12.575 | 0 | 1 |
| Sampel 2 (perlakuan) |
14.065 | -1.92 | 3.784 |
Grafik Fold gene expression IL-1β & COL-A
Berikut ini merupakan perbandingan hasil dari perhitungan Fold gene expression pada target gen IL-1β & COL-A.
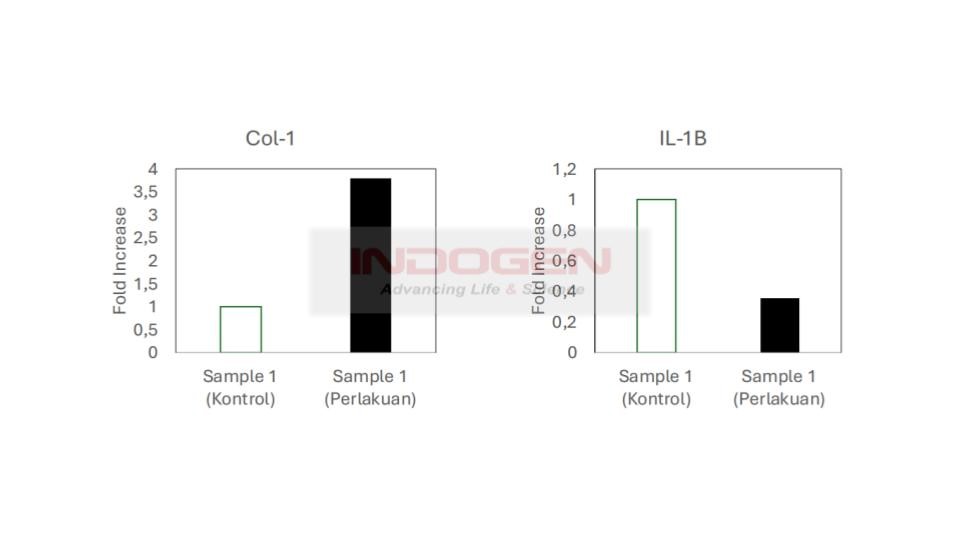
Gambar 15. Grafik Fold gene Expression IL-1β & COL-A
Berdasarkan hasil dari analisa RT-PCR dapat disimpulkan pada sampel perlakuan mengalami perubahan ekspresi gen baik itu gen COL-A maupun IL-1β. Terjadi peningkatan ekspresi gen IL-1β dan penurunan ekspresi gen COL-A.

